
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Загальна характеристика і властивості розчинів
Існують два види розчинів: дійсні та дисперсні.
Розчинами називають багатокомпонентні системи, в яких одна або декілька речовин розподіляються в іншій речовині - розчиннику. Фізична хімія вивчає властивості дійсних розчинів.
Дійсними називають розчини, в яких речовина розчиняється до молекул та іонів.
Якщо речовина розчиняється до іонів, то такі розчини називають розчини електролітів.
Якщо речовина розчиняється до молекул, то такі розчини називають розчинами неелектролітів.
Розчини електролітів проводять електричний струм, а неелектроліти не проводять. До електролітів відносяться розчини кислот, солей та гідроксидів. До неелектролітів - органічні розчини: цукру, крохмалю, карбонових кислот.
Дисперсними системами називають розчини, в яких речовина розчиняється до колоїдних часток - міцел. Дисперсні системи поділяють на грубодисперсні (крейда, борошно у воді, цементний розчин) і колоїдно-дисперсні (AgСІ, Fe(ОН)3) .
Способи вираження концентрації.
1. Масова доля речовини - це безрозмірна фізична величина, яка дорівнює підношенню маси речовини до загальної маси розчину.
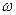 =
=  ×100% (в %)
×100% (в %)
2. Молярна концентрація виражається числом молей розчиненої речовини в 1 дм3.
СМ =  (г/моль)
(г/моль)
3. Еквівалентна концентрація (концентрація еквівалентів) виражається числом моль-еквівалентів розчиненої речовини в 1 дм3 розчину.
Сэ =  (моль × екв/дм3)
(моль × екв/дм3)
За типом розчини бувають: газові, рідкі, тверді. Газові розчини - суміш газів.
Тверді розчини - сплави металів, солей. Рідкі розчини газу у рідині, рідини у рідині, твердої речовини у рідині. Розчинність газів у рідині залежить від температури і тиску. Чим нижче температура і вищий тиск, тим краще розчинність. На відміну від газів розчинність рідини у рідині може бути різноманітною: безмежна - етиловий спирт у воді, обмежена - анілін у воді, повна нерозчинність - ртуть у воді.
Розчинність рідини залежить від температури: чим вище температура, тим більша розчинність рідини в іншій. Підвищення температури дає можливість перевести обмежену розчинність в безмежну, та температура, при якій обмежена розчинність переходить у безмежну, називають критичною.
Критична температура - це характеристика кожної рідини. По критичній температурі у харчовій промисловості відрізняють вершкове масло від маргарину.
Тверді тіла у рідких розчинниках розчиняються обмежено. Розчинність підвищується з підвищенням температури.
Але існують деякі винятки: існують речовини, які не змінюють свою розчинність з підвищенням температури і існують речовини, розчинність яких збільшується із зниженням температури.
Розчинність твердих речовин у розчинах вперше вірно пояснив Менделєєв у своїй гідратній теорії. Відповідно до гідратної теорії процес розчинення можливо пояснити на такому прикладі, якщо кристал NaСІ занурити у воду, то розчинення піде таким чином: відповідно до теорії Менделєєва процес розчинення здійснюється за такими стадіями:
1) гідратація іонів (взаємодія з молекулами води).Виникають сили когезії. Супроводжується виділенням тепла, оскільки утворюються нові зв'язки.
2) Руйнування сил когезії (руйнування кристалічної решітки супроводжується
поглинанням тепла).
3)Утворення гідратів і розподіл їх у масі розчинника.
|
Гідрати - нестійкі фізико - хімічні з'єднання. Рушійною силою є кінетична енергія розчинника.
Теплота розчинення - це сума теплоти, яка витрачається на руйнування сил когезії та тепла, яке виділяється при утворенні сил адгезії.
Процес розчинення завжди супроводжується зміною об’єму. Об'єм може зменшитися, збільшитися чи залишитися незмінним. Це залежить від сил адгезії та когезії. Якщо сили адгезії більше сил когезії, то об'єм зменшується, і процес супроводжується виділенням тепла. Якщо сили адгезії менше сил когезії, то об'єм збільшується, і процес супроводжується поглинанням тепла. Якщо сили адгезії та когезії рівні, то об'єм не змінюється і тепловим ефектом процес не супроводжується.
Читайте також:
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. Морфофункціональна характеристика відділів головного мозку
- Ni - загальна кількість періодів, протягом яких діє процентна ставка ri.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Агрегативна стійкість і коагуляція колоїдних розчинів
- Аеродинамічні властивості колісної машини
- Амплітудно-частотна характеристика, смуга пропускання і загасання
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
| <== попередня сторінка | | | наступна сторінка ==> |
| Фазові рівноваги. Загальні умови. Правило фаз. | | | Лекція № 7 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |