
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Розчинення в розчинах електролітів
Часткова концентрація розчинів неелектролітів виражається молекулами, розчинів сильних електролітів – іонами, слабих електролітів - молекулами і іонами.
Щоб знайти часткову концентрацію розчину електроліту, крім кількості молів і молекул, необхідно знайти ступінь дисоціації aі кількість іонів, на які дисоціюють молекули k.
Розрахувати часткову концентрацію розчину H2SO4, що містить 1000 молекул кислоти, якщо ступінь дисоціації цієї кислоти 70%.
1)Скільки молекул продисоційованих на іони?
всі молекули - 100%
х молекул - 70%
х = 1000 ∙ 70 / 100 = 700
2) Скільки недисоційованих молекул ?
1000-700 = 300
3) Скільки іонів у розчині ?
H2SO4 Û 2Н+ + SO42- = 3 іона
3 ∙ 700 = 2100 ( іонів )
4) Часткова концентрація розчину дорівнює :
2100 + 300 = 2400
Два розчини, які містять однакову кількість молів розчиненої речовини, а відповідно і молекул, називаються еквімолекулярними.
У теорію розчинів Вант - Гофф вводить поняття ізотонічного коефіцієнту і, який показує, у скільки разів часткова концентрація електроліту більша, ніж часткова концентрація еквімолекулярного розчину неелектроліту.
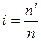

де, n¢- чаткова концентрація електроліту
n- часткова концентрація неелектроліту;
Ізотонічний коефіцієнт показує, у скільки разів усі фізичні властивості розчинів електролітів яскравіше виражені, ніж фізичні властивості неелектролітів.
і=n¢/n; і=П¢/П; і=DР¢/DР; і= Dtк¢/Dtk; і=Dtз¢/Dtз.
Ізотонічний коефіцієнт знаходиться у такій залежності із ступенем електролітичної дисоціації.
 ∙ 100%
∙ 100%
k – величина, яка показує на скільки іонів дисоціює молекула.
Оскільки цей закон використовують для розведених розчинів електролітів, то
n – має маленьке значення і закон Рауля записується так :

DР- зниження тиску пари над розчином:
DР = Р0 – Р
Для розв’язання задач використовують:

Читайте також:
- Адсорбція електролітів
- Адсорбція електролітів
- Електролітична дисоціація (йонізація) — це розпад електролітів на сольватовані (гідратовані) йони під дією молекул розчинника.
- Електропровідність електролітів. Питома, еквівалентна і загальна.
- Кладка на розчинах з протиморозними хімічними добавками
- КЛАСИФІКАЦІЯ ТА СУТНІСТЬ МЕТОДІВ ВИЗНАЧЕННЯ СУХИХ РЕЧОВИН У РОЗЧИНАХ
- Плазма, склад, види та роль електролітів і білків плазми. Кислотно-основний стан крові, роль буферних систем у регуляції його сталості.
- Реакції обміну в розчинах електролітів.
- Розчинення газів у рідинах.
- Розчинення твердих речовин у рідинах.
- Розчини електролітів.
| <== попередня сторінка | | | наступна сторінка ==> |
| Закони Рауля для відносного зниження тиску над розчином | | | Температури замерзання |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |