
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція 9.
Лекції зі спецкурсу, частина 2
Тема: Спряжені дієни
Зміст
1. Одержання дивінілу, вирівнювання зв’язків у дивінілі.
2. Конфігурації спряжених дієнів.
3. Приєднання до спряжених дієнів водню. Приєднання до спряжених дієнів галогенів, механізм реакції, поняття про продукти, що контролюються термодинамічно та кінетично. Діаграма реакції.
4. Одержання хлоропрену, приєднання до спряжених дієнів галогеноводнів.
5. Поняття про метод молекулярних орбіталей (МО). МО водню.
6. Реакція Дільса-Альдера, збереження конфігурації реагентів у аддукті. Взаємодія гранічних МО – НЗМО та НВМО.
7. Циклоолігомерізація дивінілу. Електроциклічні процеси.
Ключові слова:
Перициклічні реакції, дивініл, реакція Дільса-Альдера, конротаторне та дисротаторне обертання.
Цілі та завдання вивчення розділу
Успішне вивчення розділу дозволяє:
Мати уяву про особливості хімічних властивостей дивінілу, зумовлені його будовою.
Вміти застосовувати метод молекулярних орбіталей для прогнозування будови продуктів деяких реакцій.
Володіти ключовими поняттями: діаграма реакції, метод молекулярних орбіталей, взаємодія гранічних МО – НЗМО та НВМО, s-цис, s-транс.
Навчальний матеріал
У спряжених дієнах електрони обох π–зв’язків активно взаємодіють один з одним. У результаті цього довжини вуглець-вуглецевих зв’язків у дієновій системі деякою мірою зрівнюються. Так, у дивінілі відстані С1—С2 і С3—С4 більше, ніж для подвійного С=С -зв’язку в алкенах (0,134 нм), і складають 0,137 нм, а відстань С2—С3 дорівнює 0,146 нм замість 0,154 нм для ординарного С—С-зв’язку в алкенах.
Яка довжина зв’язків в молекулі бензолу?
Збільшення π–характеру С2—С3-зв’язку приводить до того, що обертання навколо неї утруднюється. Завдяки цьому стає можливим розрізняти конформери із "трансоїдним" і "цисоїдним" розташуванням вінільних груп:
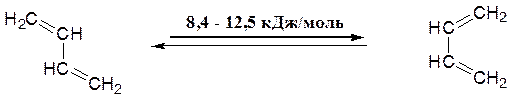
Такі конформери, які у випадку дивінілу досить легко переходять друг у друга, називають s–транс– і s–цис–ізомерами, оскільки вони розрізняються за геометрією щодо ординарного (sіngle) зв’язку. Зрозуміло, що для заміщених бутадієнів легкість взаємних s–транс– і s–цис–переходів буде суттєво залежати від природи і розташування замісників.
Як?
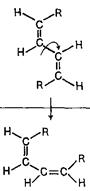
Коли говорять про конфігурації спряжених дієнів, то мають на увазі розташування замісників у кожній з вінільних груп. Наприклад, молекули 1,4-діалкілбутадієнів-1,3 (обидва алкіли однакові) можуть мати три конфігурації, кожна з яких може існувати у виді двох s-форм.
З наведеної нижче таблиці можна побачити, що найбільші просторові утруднення буде зазнавати алкадієн цис, цис-конфігурації в s-цис-формі (взаємодія зближених радикалів R). Подібний аналіз може бути проведений також для дієнів з іншим положенням та кількістю замісників (алкільних груп).
Конфигурации и конформации 1,4-диалкилбутадиенов-1,3
| Кон-форма-ції | Конфигурації | ||
| транс-транс або Е,Е | транс-цис або Е,Z | цис-цис або Z,Z | |
| s-транс s-цис | 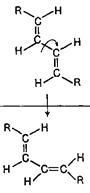
| 
| 
|
Спряжені дієни характеризуються делокалізованим зв’язком.
Як Ви розумієте поняття делокалізований зв’язок? Які зв’язкі є локалізованими?
Делокализація важлива для стабілізації збуджених станів дієнів і взагалі полієнів, так як знижує енергію цих станів. Ефект делокалізації при цьому зводиться до того, що зменшується щілина між енергетичними рівнями основного й збудженого станів спряжених молекул в порівнянні з відповідними характеристиками молекул із ізольованими подвійними зв’язками. Дійсно, по мірі збільшення ступеня спряження вказана енергетична щілина поступово зменшується. Кількість енергії, необхідна для переходу молекули з основного стану в збуджене, знижується, внаслідок чого довжина хвилі випромінювання, яка поглинається спряженою системою, збільшується. Прості дієни поглинають в УФ-області спектру, однак по мірі збільшення ступеня спряження поглинання поступово зміщується в видиму область, тобто сполуки набувають кольору.
Пригадайте з курсу неорганічної хімії, що таке водень в момент його виділення.
Алкени та алкадієни із ізольованими подвійними зв’язками не відновлюються воднем в момент його виділення. Спряжені ж дієни переходять при цьому в алкени. Якщо дієнова система не містить алкільних груп в положеннях 1 та 4, то гідрування проходить практично тільки як 1,4-приєднання:
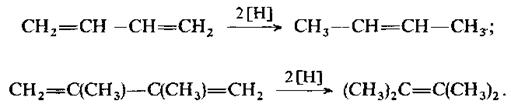
Коли положення 1 та 4 повністю заміщені, то проходить переважно 1,2-приєднання:
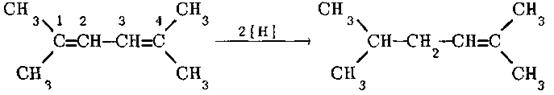
Прочитайте та законспектуйте:
При каталітичному гідруванні, яке здійснюється з використанням тих же гетерогенних каталізаторів та проводиться в тих же умовах, що й гідрування алкенів, всі алкадієни дають відповідні алкани. Вивчення теплот гідрування дієнів показало, що системи із спряженими подвійними зв’язками володіють більш низькими енергіями, ніж можна було б чекати з розрахунків і чим це спостерігається для ізольованих дієнів. Це свідчить про те, що вони мають бути стійкіші останніх і що спряження веде не тільки до змінення довжин зв’язків у системі дивінілу, але й до виграшу енергії. Так, каталітичне відновлення подвійного зв’язку в бутені-1 супроводжується, як вже відмічалося, виділенням 127 кДж/моль тепла й веде до утворення н-бутану. В той же час при гідруванні в тих же умовах двох подвійних зв’язків в молекулі бутадієну-1,3, що також веде до утворення н-бутану, виділяється не 254 кДж/моль (тобто 127 кДж/моль · 2), а лише 239 кДж/моль тепла. Отже, якщо в молекулу, що має визначений вуглецевий скелет, ввести фрагмент з двома спряженими подвійними зв’язками, то її енергія збільшується в меньшій мірі, чим можна було б чекати, виходячи з даних про підвищення енергії при введені у відповідне місце тієї ж молекули (в данному випадк в α-положення) одного подвійного зв’язку:
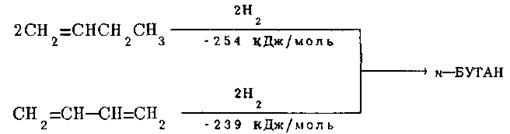
Як видно з наведених вище даних, у випадку бутадієну-1,3 такий виграш енергії складає 254-239 = 15 кДж/моль.
Аналогічні результати одержують і у випадку пентадієну-1,3 (піперилену), який звичайно існує в транс-конфігурації. Його каталітичне гідрування супроводжується утворенням н-пентану та виділенням 226 кДж/моль тепла:
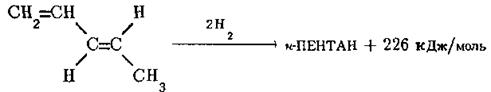
Молекула піперилену містить один подвійний зв’язок в положенні 1 і вінільний фрагмент в транс-конфігурації в положеннях 3, 4, тому очікувану теплоту гідрування піперилену слід розраховувати як суму теплот гідрування пентену‑1 та транс-пентену-2:
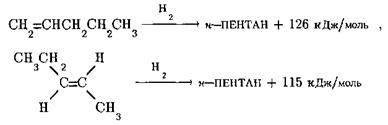
Якщо б дотримувалась аддитивність, теплота гідрування піперилену мала б складати 126 + 115 = 241 кДж/моль. Різниця між розрахованими та фактично знайденими значеннями теплоти гідрування піперилену складає 241 —226 = 15 кДж/моль, тобто виграш енергії за рахунок спряження й в цьому випадку практично такий же, як для бутадієну-1,3.
Щоб підкреслити, що цей ефект зумовлен спряженям, відмітимо, що теплота гідрування ізольованиго дієну – пентадієну-1,4 – навіть дещо перевищує розраховану за аддитивною схемою (126 · 2 = 252 кДж/моль):
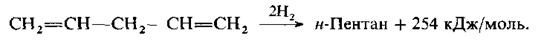
При приєднанні до однієї молекули бутадієну однієї молекули брому утворюються ненасичені диброміди – продукти приєднання молекули брому до дієнової системи. При низькій температурі утворюється переважно 1,2-дибромид, а при підвищеній – 1,4-дибромид:
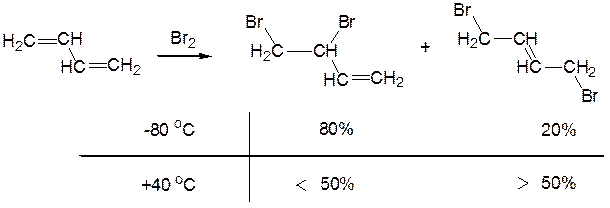
Пригадайте попередні розділи й поясніть підвищену стійкість часток алільного типу.
У молекулі дивінілу є два нерівноцінних положення, на які спочатку могла б, у принципі, бути спрямована атака електрофілу, – це периферійні (положення 1 і 4) і центральні (положення 2 і 3) атоми карбону. Атака по положеннях 2 і 3 приводить до утворення проміжного первинного карбокатіону, що, як відомо, є одним з найменш енергетично вигідних варіантів. Якщо ж катіон брому взаємодіє з одним з периферійних карбонових атомів (положення 1 або 4), то утворюється карбокатіон аллільного типу, у якому позитивний заряд делокалізується за рахунок зсуву рухливих електронів π–зв’язку сусідньої вінільної групи:
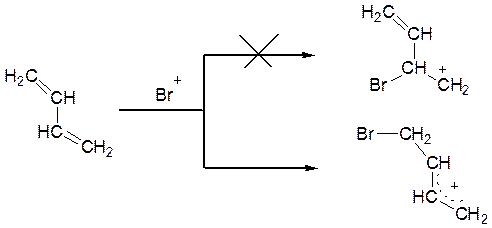
Застосовуючи до розглянутого випадку той же підхід, що і для аллільного радикалу, можна відобразити особливості такої делокалізації не тільки одною формулою з усередненим зарядом, як у наведеній вище схемі, але і двома крайніми резонансними формами з локалізованими зарядами:
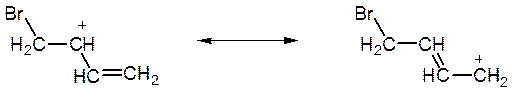
Як уже говорилося, подібний ефект, що є наслідком легкості зсуву рухливих електронів π–зв’язку, виявляється досить яскраво. Завдяки цьому катіони аллільного типу утворюються порівняно легко.
Таким чином, взаємодія дивінілу (і інших сполучених дієнів) із бромом і іншими електрофільними реагентами повинна починатися з атаки по положеннях 1 або 4.
Катіон, що утворився, далі стабілізується, приєднуючи бромід-аніон по положеннях 4 (1,4-приєднання) або 2 (1,2-приєднання):
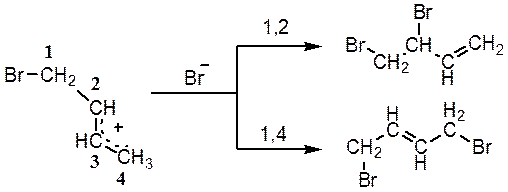
Занотуйте:
Сильна залежність напрямку реакції (власне кажучи напрямку приєднання бромід-аніону) від температури пояснюється тим, що при –80 °C бромід-аніон нездатен для досить швидкої міграції і залишається в тому місці, де він утворився, тобто поблизу карбенієвого центру С2, до якого переважно і приєднується. З цієї причини продукт 1,2-приєднання – 3,4-дибромбутен-1 – утвориться швидше ізомерного йому 1,4-дибромбутена-2, і його називають кінетично контрольованим продуктом реакції.
При +40 °C, як було показано спеціальними дослідами, зазначені диброміди, досить стійкі при –80 °C, здобувають здатність до взаємоперетворення:
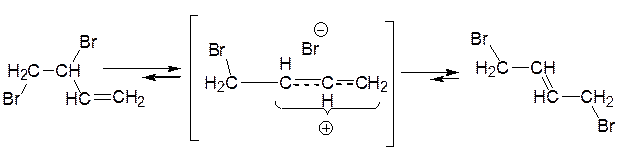
Занотуйте:
1,4-Дибромид, як більш заміщений алкен, більш стійкий і від нього важче, ніж від 1,2-дибромида, відщеплюється бромід-аніон. Завдяки цьому він і накопичується в реакційній суміші, коли бромування проводять при +40 °C. Більш стійкий 1,4-дибромид називають термодинамічно контрольованим продуктом реакції.
Корисні відомості про перехід другої стадії приєднання брому зо бутадієну дає розгляд діаграми цієї реакції.
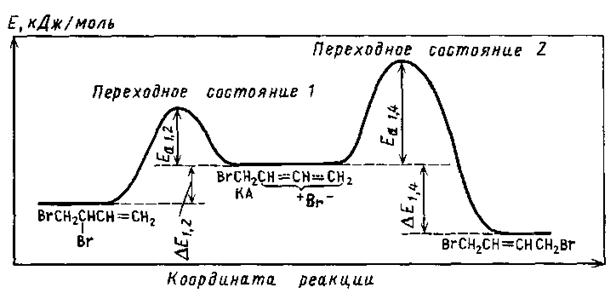
Енергетичний профіль реакції гідробромування бутадієну
За низьких температур 3,4-дибромбутен-1, що утворився на першій стадії бромування, достатньо стійкий. Проте за високих температур він порівняно легко диссоціює, даючи катіон алільного типу (KA) і бромід-аніон. Це перетворення проходить як безперервний процес і вимагає витрати енергії ΔЕ1,2 + Ea1,2 (перехідний стан 1). Катіон, що утворився, достатньо стійкий, і подальше його перетворення вимагає додаткових витрат енергії. Частинки, подібні до даного катіона, називаються проміжними сполуками. Енергетичний бар'єр Еа1,4 при переході від KA до 1,4-дибромбутену-2 (перехідний стан 2) відповідає максимуму енергії системи й супроводжується виділенням енергії Ea1,4 + DE1,4. Оскільки 1,4-дибромбутен-2 стійкіший, ніж 3,4-дибромбутен-1, зворотний перехід від 1,4-диброміду до KA здійснюється важче (енергія активації цього процесу Ea1,4 + DE1,4), ніж у разі 1,2-диброміду. З цієї причини з часом 1,4-дібромид стає за високих температур головним продуктом реакції.
Очевидно, що аналогічним чином відбувається приєднання до спряжених дієнів стехіометричної кількості хлору. Цю реакцію використовують в промисловості для синтезу – хлоропрену – важливої речовини, з якої отримують полімерні матеріали:
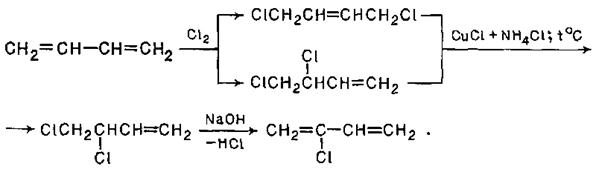
Приєднання до спряжених дієнів хлороводню та бромоводню відбувається по схемі, аналогічній розглянутій вище для бромування:
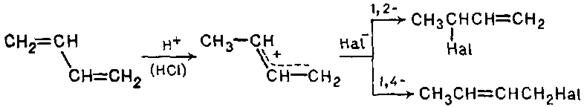
При цьому спостерігається та ж закономірність, що і у разі галогенів: при низьких температурах переважає 1,2-приєднання, а при підвищених - 1,4-приєднання.
Прочитайте та законспектуйте основні положення:
Поняття про метод молекулярних орбіталей (МО). МО водню. Відомо, що молекули органічних сполук здатні переходити в збуджений стан і поглинати при цьому енергію. Опромінювання органічної молекули світлом з довжиною хвилі 200-450 нм викликає вже не тільки коливальні рухи, як при ІЧ-випромінюванні, але й переміщення електрону з одного енергетичного рівня на іншій, вищий. При цьому маються на увазі енергетичні електронні рівні молекули в цілому. Розгляд молекули як самостійного єдиного цілого, а не простій сукупності атомів, здійснюється за допомогою так званого «методу молекулярних орбіталей». Цей метод припускає, що електрони в молекулі належать не окремим атомам, а всій молекулі. То ж відноситься, звичайно, й до енергетичних рівнів електронів, які називаються молекулярними орбіталями (МО). МО - це математичне поняття, абстрактне і справедливе тільки в рамках теорії МО. Кожна молекула має деяке число МО, які по енергії розташовуюься «драбинкою». Вони можуть бути вільними або зайнятими. У молекулах органічних сполук зазвичай є як вільні, так і зайняті МО. На мал. показаний пунктиром незв'язуючий рівень (що не зв'язує МО). На незв'язуючій орбіталі знаходяться, наприклад, неподілені пари електронів. Ця орбіталь не зв'язує ніяких атомів. Нижче по енергії, ніж незв'язуюча МО, знаходяться зв'язуючі, а вище - розпушуючі, або антизв'язуючі орбіталі.

Енергетичні рівні молекулярних орбіталей
Уявимо собі молекулу (в рамках представлень методу МО), в якій зовсім немає електронів. У ній є орбіталі, але ця система не має виграшу енергії в порівнянні з ядрами атомів, узятими окремо, оскільки немає субстанції, що утримує ядра разом. Отже, в даному випадку ядра повинні «розлетітися», хоча в їх конгломераті є молекулярні орбіталі. Тепер до цього конгломерату додаватимемо електрони. Один займе нижчу МО (енергетично вигідно), другий з протилежним спином (принцип Паулі), - ту ж МО, третій, - наступну МО з вищим енергетичним рівнем, четвертий з протилежним спином, - її ж, і т.д.
Нарешті, заповнивши попарно електронами що зв'язуючі МО, отримуємо найбільш стабільну молекулу. Якщо в молекулі є незв'язуюча МО, то розміщення на неї пари електронів ніяк не позначиться на енергії молекули.
Проте якщо почати заповнювати електронами розпушуючі орбіталі, то енергія молекули зростатиме – відбудеться програш енергії.
Зобразіть на малюнку поданий нижче матеріал стосовно молекули водню.
На прикладі молекули водню найлегше показати, як утворюються зв'язуючі й розпушуючі МО. У атома водня є 1s-орбіталь, яка має сферичну симетрію. При достатньому зближенні в просторі двох атомів водню їх атомні орбитали (АО) починають перекриватися. Згідно теорії МО при перекритті двох АО можуть утворюватися дві й лише дві (з трьох-три, з чотирьох-чотири, і т д.) нові орбіталі, які називаються МО. Одна орбіталь, енергія якої менша, утворюється при перекритті хвильових функцій у фазі (складання), а друга – при перекритті їх в протифазі (віднімання). На малюнку зображені МО молекули H2, що утворюються при взаємодії атомних орбіталей атомів водню. У основному стані молекули H2 обидва електрони заселяють зв'язуючу орбіталь, що приводить до виграшу енергії (в порівнянні з системою з двох окремих атомів), рівному 2 E (по 1 E на кожен електрон). Молекулярні орбіталі розрізняються не тільки по енергії, але й по симетрії. Наприклад, відносно дзеркальної площини, перпендикулярної лінії, що сполучає ядра H, зв'язуюча МО симетрична (не міняє знак при віддзеркаленні), а розпушуюча – антисиметрична.
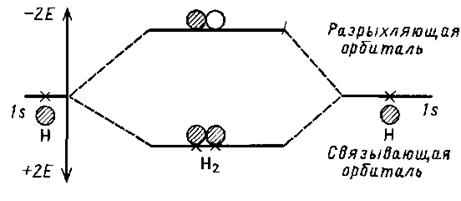
Молекулярні орбіталі молекули водню
Розглянемо тепер взаємодію протонів, гідрид-аніонів і атомарних воднів в різних комбінаціях, яке могло б привести до утворення нової молекули з тією ж масою, що й молекула водню.
При взаємодії двох протонів повинна була б утворитися молекула H22+. Проте в цьому випадку в системі не буде електронів – матеріальних носіїв енергії МО. З цієї причини вказана молекула нездібна до існування.
З протона й атомарного водню утворюватиметься молекула H2+, але зв'язок між складовими її фрагментами буде удвічі слабкіше, ніж в звичайній молекулі водню. Це викликано тим, що в даному випадку на зв'язуючій МО знаходитиметься тільки один електрон (зменшення енергії системи в порівнянні з ізольованими частинками H+ і H складає 1 E).
Атомарний водень і гідрид-аніон дадуть молекулу H2– з таким же слабким зв'язком між фрагментами, як і у попередньому випадку, оскільки виграш енергії від знаходження двох електронів на зв'язуючій МО удвічі зменшується від перебування третього електрона на розпушуючій МО.
При спробі сформувати молекулу з двох гідрид-аніонів виникне необхідність повністю зайняти як зв'язуючу, так і розпушуючу МО, що приведе до того, що виграшу енергії не буде зовсім. Два гідрид-аніони не взаємодіятимуть і «розлетяться», як і два протони: необхідність зайняти в рівній мірі як зв'язуючу, так і розпушуючу орбіталі в молекулі гелію є причиною неможливості її існування.
Щоб правильно застосовувати теорію МО в органічній хімії, необхідно не тільки вміти будувати МО з АО і правильно встановлювати їх симетрію, але й уміти визначати енергії окремих МО, які є важливою характеристикою молекул. Для вирішення цього питання створені розрахункові методи й так звана «експериментальна квантова хімія» - фото- та рентгеноелектронна спектроскопія. Суть цих спектроскопічних методів полягає в тому, що за допомогою фотонів можна вибивати електрон навіть з 1s-рівней. Проте ці методи порівняно нові й лише починають входити в практику дослідження.
Прочитайте та законспектуйте основні положення:
Реакція Дільса-Альдера, збереження конфігурації реагентів у аддукті. Взаємодія гранічних МО – НЗМО та НВМО. Як встановив С.В.Лєбєдєв, дивініл димеризується при нагріванні до 150°C. Це перетворення, як і димеризація алленів, є прикладом реакції циклоприєднання. При цьому одна молекула дивінілу реагує, будучи в «цисоїдній» s-цис-конформації по положеннях 1 і 4, а друга - в «трансоїдній» s-транс-конформации по положеннях 1 і 2. Перша виступає як дієн, а друга - як дієнофіл; продукт реакції називають аддуктом:
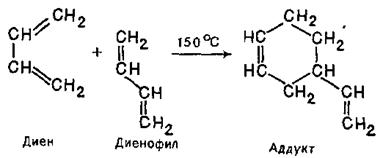
Реакція зазвичай проходить легко та швидко й веде до утворення карбон–карбонового зв’язку. Дієн має реагувати в цисоїдній (А), а не в трансоїдній (Б) конформації:

Циклічні дієни, які знаходяться в цисоїдній конформації, наприклад дієн (В), реагують значно швидше, аніж ациклічні дієни, в яких потрібна конформація має бути досягнена шляхом обертання навколо простого зв’язку (трансоїдна конформація зазвичай більш стійка). Так, циклопентадієн достатньо реакційноздатний, і дві молекули такого дієну можуть дати трициклічний димер. Ця реакція, подібно більшості реакцій Дільса—Альдера, оборотна.
Ці реакції активуються електронодонорними замісниками в дієні й електроноакцепторними замісниками в алкені — дієнофілі. Реакції з простими незаміщеними алкенами зазвичай ідуть важко.
Чим відрізняються електронодонорні замісники від електроноакцепторних?
Подібні реакції були детально вивчені Дільсом і Альдером і отримали назву дієнового синтезу. Дієновий синтез став одним з найважливіших методів отримання циклічних сполук. Як дієнофіли використовують широкий асортимент сполук ряду етилену, що зазвичай містять електроноакцепторні замісники у вінільному фрагменті. Виявилось, що ця реакція не супроводжується утворенням яких-небудь проміжних частинок і що конфігурація дієнофілу зберігається в аддукті:
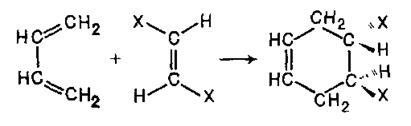
або
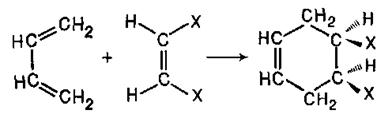
Оскільки в даній реакції система з чотирьох р-електронів взаємодіє з системою з двох р-електронів, її називають «4+2 – циклоприєднанням». Механізм таких реакцій довгий час був неясний і їх називали реакціями «без механізму»: експериментальні дані, що були, свідчили лише про те, що в процесі перетворення утворюються комплекси (іноді їх називали «іонними»), в яких переміщення кратних зв'язків відбувається синхронно або, як кажуть, погоджено.
Запропонуйте реакцію «2+2 – циклоприєднання» та «3+2 – циклоприєднання».
У 1965 р. Вудвард і Гофман опублікували серію робіт, в яких виклали теорію, що дозволяє передбачити для кожного конкретного випадку, низьку або високу енергію активації матиме реакція, якщо її ініціювати нагріванням або УФ-випромінюванням (ми розглянемо тільки ініціацію нагріванням, коли реагенти взаємодіють в основному, а не у збудженому стані). Низька енергія активації, як показали автори, властива лише дозволеним процесам, тобто тим, які проходять через стадію утворення реакційних комплексів, в яких досягається максимальне зв’язування.
Останнє, як вже наголошувалося, здійснюється в результаті взаємодії р-орбіталей, які зазвичай зображають у вигляді двох долей, кожній з яких додають знак « + » або « — », означаючи тим самим, що електрони, які знаходяться на них, можуть бути у фазі або в протифазі. При зближенні долей орбіталей з однаковими знаками відбувається зв’язуюча, а з протилежними - розпушуюча взаємодія.

Отже, низьку енергію активації повинні мати процеси, при яких зближуються долі орбіталей з однаковими знаками.
Було встановлено, що енергетика даних реакцій визначається взаємодією так званих граничних молекулярних орбіталей – верхньою зайнятою (ВЗМО) і нижньою вільною (HВMO) (слід мати на увазі, що крім дієнового синтезу й інших реакцій циклоприєднання сказане відноситься також до перетворень, які проходять синхронно через стадію утворення циклічних перехідних станів і які об'єднують під загальною назвою «Перициклічні реакції»).
Зважаючи на все викладене вище, побудуємо ВЗМО і HВMO для молекул етилену й бутадієну. У етилені взаємодіють дві атомні орбіталі карбону й відповідно до цього виникають дві молекулярні орбіталі – зв'язуюча (долі обох орбіталей взаємодіють у фазі) і розпушуюча (взаємодія здійснюється в протифазі). Зв'язуюча орбіталь ψ1 несе два електрони, а розпушуюча орбіталь ψ2 вільна:
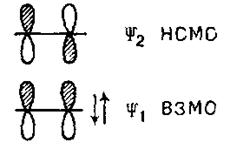
Отже, для етилену ВЗМО буде орбіталь ψ1; а HВMO – орбіталь ψ2. Орбіталь ψ1 симетрична щодо площини, що проходить через середину міжядерної лінії перпендикулярно їй. Орбіталь ψ2 антисиметрична щодо тієї ж площини й містить один вузол (місце зміни знаку сусідньої орбіталі).
Аналогічний підхід застосовують до побудови молекулярних орбіталей бутадієну: їх повинно бути чотири (взаємодіють чотири атомні орбитали) – дві зв'язуючі й дві розпушуючі:
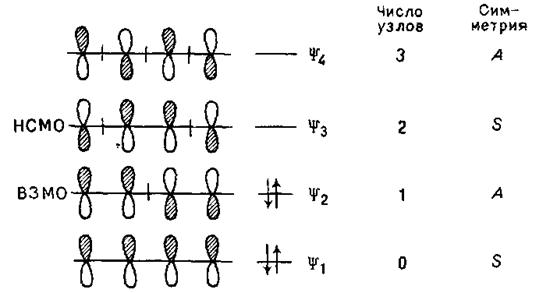
Орбіталі ψ1 і ψ2 – зв’язуючі: ψ1 симметрична і не має вузлів, ψ2, ВЗМО, – антисиметрична і має один вузол. Розпушуюча орбіталь ψ3, HВMO, – симетрична й має два вузли, а розпушуюча орбіталь ψ4 антисиметрична і має три вузли.
При дієновому синтезі можуть реалізуватися два варіанти, коли у взаємодії беруть участь: HВMO дієнофілу (етилену) і ВЗМО дієну, в цьому випадку дієнофіл є акцептором електронів, а дієн – донором; ВЗМО дієнофілу і HВMO дієну, в цьому випадку дієнофіл є донором електронів:
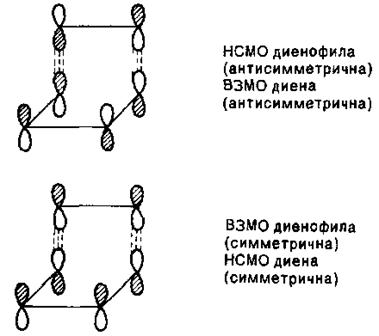
Таким чином, в процесі дієнового синтезу взаємодіють орбіталі однакової симетрії.
Оскільки при формуванні перициклічного перехідного стану одночасно фіксуються обидва кінці дієнофілу, конфігурація його зберігається в продукті реакції.
Запищіть:
До перициклічних реакцій відноситься також взаємодія спряжених дієнів з діоксидом сірки (витримка в запаяній судині при кімнатній температурі):
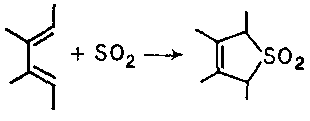
Було знайдено, що в цю реакцію, яку відносять до класу так званих хелетропних, не вступають дієни, що містять хоч би в одного з кінцевих атомів карбону (тобто С1 або С4) дві алкільні групи. Мабуть, це пояснюється просторовою утрудненістю s-цис-конформаціївідповідного дієну.
З попередніх розділів пригадайте основні моменти механізму реакцій металокомплексного каталізу.
Реакції циклоприєднання широко використовують для синтезу циклічних систем із спряжених дієнів. Саме до таких реакцій дивінілу, що дозволяє отримувати на його основі труднодоступні іншими шляхами аліцикли, відноситься циклоолігомеризація дивінілу. Надзвичайно активними каталізаторами цього перетворення виявилися комплекси Ni0. Припускають, що вказані реакції протікають через стадію утворення так званих р-алільних комплексів:
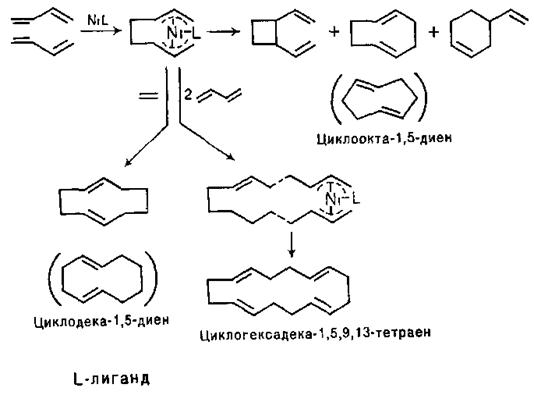
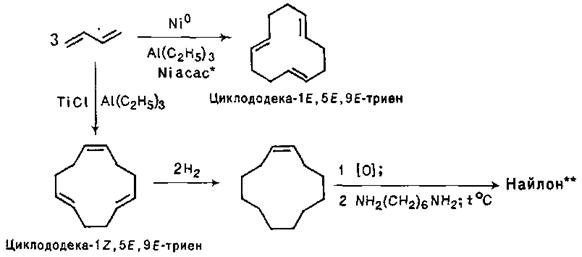
Для тримеризації дивінілу як каталізатори використовують також комплекси етилалюмінію:
З погляду теорії перициклічних реакцій дуже повчальне оборотне перетворення спряжених дієнів і триєнів відповідно в циклобутени та циклогексадієни. Воно відноситься до так званих електроциклічних реакцій – процесів, в результаті яких відбувається взаємоперетворення нециклічного полієну і циклічної сполуки. Прикладами можуть служити оборотні циклізації дивінілу в циклобутен і гексатриєну в циклогексадієн при нагріванні:
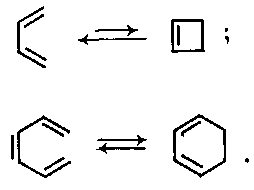
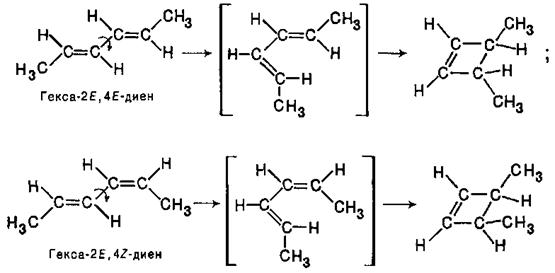
Було показано, що ці реакції проходять стереоспецифічно. Так, при циклізації гекса-2Е,4Е-дієнів і гекca-2E,4Z-дієнів утворюються, відповідно, транс- і цис-1,2-диметилциклобутени-3:
З 2,4,6-октатриєнів 2E,4Z,6E- і 2Е,4Z,6Z-конфігурацій при цьому виходять, відповідно, цис- і транс-1,2-диметилциклогексадієни-3,5:
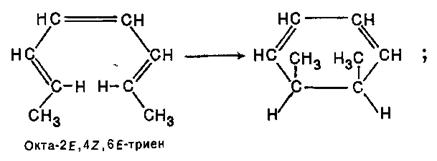
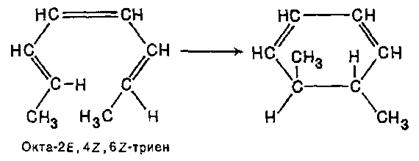
Ці результати можна пояснити тим, що в перетворенні повинна брати участь ВЗМО нециклічного полієну і що в перехідному циклічному стані повинні перекриватися орбітальні долі однакового знаку при кінцевих атомах вуглецю спрояженого полієнового ланцюга.
Занотуйте:
Розглянемо спряжені дієни. ВЗМО для бутадієну-1,3 наведена вище. Такою ж вона буде й для гексадієну-2,4. Як вже вказувалося, саме вона бере участь в процесі циклізації. Для того, щоб відбулося перекриття долей орбіталей при С1 і С4 дієнової системи в перехідному циклічному стані, а потім і утворення відповідного σ-зв’язку, необхідно, щоб зв'язки С1—С2 і С3—С4 були повернені в одному й тому ж напрямі. Такий тип обертання називається конротаторним. При конротаторному обертанні процес циклізації дієну має низьку енергію активації. Обертання ж навколо зв'язків С1—С2 і С3—С4 в протилежних напрямах називається дисротаторним. У даному випадку воно приводить до розпушуючої взаємодії:
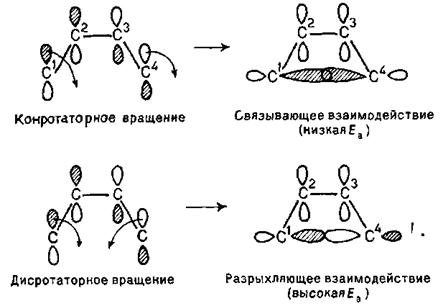
Звідси витікає, що з гексадієну 2E,4E-конфігурації при такій циклізації (конротаторне обертання) повинен виходити транс-1,2-диметилциклобутен-З, а з гексадієну 2E,4Z-конфігурації - цис-ізомер:
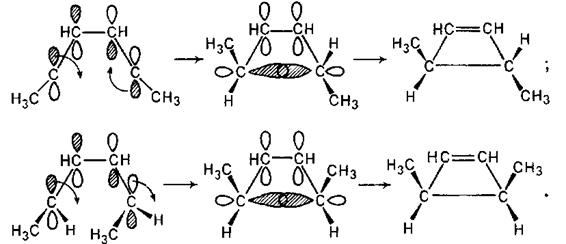
Справедливість такого підходу для пояснення результату електроциклічних реакцій підтверджується також реакцією термічної циклізації октатриєну (рівняння реакції приведене вище).
Перш за все необхідно встановити, як виглядатиме ВЗМО спряженої триєнової системи. Побудуємо для неї молекулярні орбіталі: оскільки взаємодіє шість атомних орбіталей, МО буде також шість – три в'язуючих і три розпушуючих. Три зв'язуючі орбіталі матимуть мінімальне число вузлів (відповідно 0, 1 і 2) і на них знаходитимуться всі шість р-електронів молекули триєну:
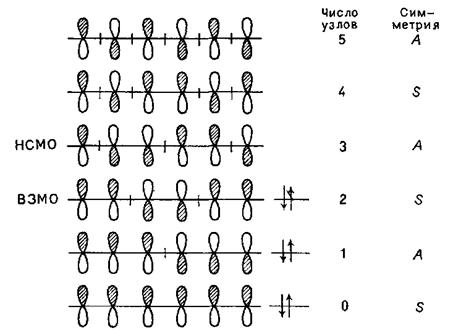
Таким чином, ВЗМО спряженої триєнової системи буде симетричною і двохвузловою.
Наведемо для 2E,4Z,6E- і 2Е,4Z,6Z-октатриєнів ті ж операції, що й для гексадієнів.
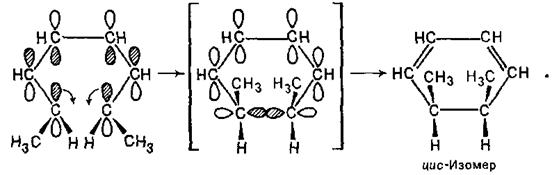
З схеми видно, що енергія активації при формуванні циклічного перехідного стану складається з октатриєну 2Е,4Z,6Е-конфігурації буде зниженою при дисротаторному обертанні, яке приводить до утворення цис-1,2-диметилциклогексадієну-3,5.
Октатрієн 2Е,4Z,6Z-конфігурації при циклізації також зазнає дисротаторного обертання, яке приводить до транс-изомеру:
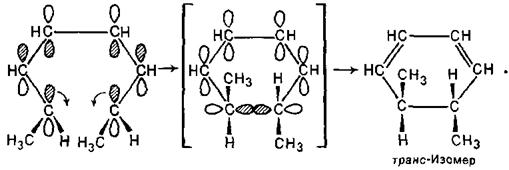
Таким чином, теоретичні уявлення про рушійні сили періциклічних реакцій отримують експериментальне підтвердження.
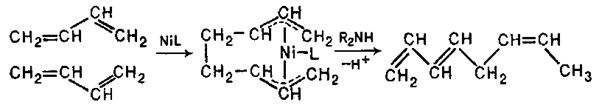
При застосуванні як каталізатору Ni0 у присутності вторинного аміну дивініл та інші спряжені дієни утворюють лінійні димери – октатрієни-1,3,6:
Питання для самоконтролю
1. Що означає литера “s” у терміні “s-цис”?
2. Яка конформація та конфігурація 1,3-дієну найбільш вигідна для нього з просторової точки зору?
3. Чому за низьких температур відбувається 1,2-приєднання до дієнів?
4. Дайте визначення хелетропним реакціям.
5. Що таке перехідний стан?
6. Як розглядає молекулу метод молекулярних орбіталей?
7. Що таке вузол орбіталі?
8. Чим відрізняється дисротаторне обертання від конротаторного?
Висновки
Однією з найважливіших реакцій спряжених дієнів є реакція Дільса-Альдера, розшифрування механізму якої стало визначною подяєю для теоретичної органічної хімії.
Читайте також:
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вступна лекція
- Вступна лекція 1. Методологічні аспекти технічного регулювання у
- Клітинна селекція рослин.
- Колекція фонограм з голосами осіб, які анонімно повідомляли про загрозу вибуху
- ЛЕКЦІЯ (4): Мануфактурний період світової економіки
- Лекція - Геополітика держави на міжнародній арені
- Лекція 02.04.2013
| <== попередня сторінка | | | наступна сторінка ==> |
| Розділ 11. ФІНАНСОВА САНАЦІЯТА БАНКРУТСТВО ПІДПРИЄМСТВ | | | Лекція 10. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |