
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук.
Валентність і валентні можливості атомів.
Тема 2.3. Періодичний закон і періодична система хімічних елементів Д.І.Менделеєва
Лекція № 7
1.Валентність і валентні можливості атомів.
Хімічні сполуки утворюються з атомів елементів відповідно до їхніх валентностей.
Отже, валентність — це міра здатності атомів елементів до утворення хімічних зв'язків.
У сучасному розумінні валентність пов'язана з електронною природою утворення хімічного зв'язку.
В утворенні зв'язків беруть участь електрони валентних підрівнів взаємозв'язаних атомів. При цьому за рахунок переходів електронів або перерозподілу електронної густини атоми намагаються набути електронної конфігурації інертних газів, у зовнішньому шарі атомів яких, за винятком гелію, міститься вісім електронів — електронний октет. Відсутність хімічної активності інертних газів засвідчує особливу стійкість їхніх електронних оболонок.
Загалом будь-які частинки, що мають неспарені електрони, називають вільними радикалами. Прикладами таких частинок можуть бути ·СН3, ·NH2 тощо (точкою позначено неспарений електрон). За звичайних умов упродовж тривалого часу більшість із них існувати не можуть, вони швидко взаємодіють між собою або з іншими подібними частинками і перетворюються на нейтральні молекули. Тому чимало хімічних реакцій вдається зрозуміти, використавши уявлення про вільні радикали. Вільнорадикальний стан складних частинок може підтримуватися за високих температур, коли одні зв'язки вже утворені (у частинці), а інші ще не виникають (між частинками). Наприклад, в атмосфері Сонця виявлено радикали ·NC, ·ОН, ·СН. У земних умовах вільні радикали утворюються під час перебігу різноманітних процесів горіння, в тому числі й під час роботи двигунів внутрішнього згоряння.
Відомі також складні радикали з довгим періодом життя. Це насамперед трифенілметил (C6H5)3C· та його похідні, досить численні
 аміноксиди, наприклад , які можуть існу-
аміноксиди, наприклад , які можуть існу-
вати у вільному стані протягом тривалого часу.
Перші уявлення про електронну природу хімічного зв'язку одно-часно в 1916 р. запропонували Г. Н. Льюїс і В. Коссель.
Г.Н.Льюїс запровадив простий і зручний спосіб зображення валентних електронів у атомах і врахування їх поведінки під час утворення зв'язків. Цей спосіб ґрунтується на зображенні електронів точками і хрестиками, або льюїсовими символами. Такі льюїсові символи складаються із символів хімічних елементів, оточених точками або хрестиками відповідно до числа валентних електронів. Наприклад, для елементів другого періоду льюїсові символи такі:
Елемент Li Be В С N О F
 Електронна конфігурація
Електронна конфігурація
зовнішнього електронного шару
Символи Льюїса
Нижче наведено схеми утворення молекул НС1, О2 та С2Н2 із застосуванням льюїсових символів.
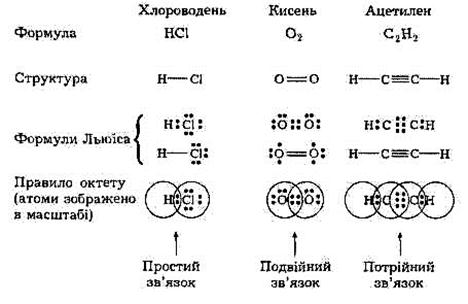 |
Отже, відповідно до уявлень Г. Н. Льюїса зв'язок виникає внаслідок утворення спільних для зв'язуваних атомів електронних пар, причому внесок кожного атома умовно зображують точками або хрестиками. Ці уявлення згодом було втілено в теорію ковалентного зв'язку.
 Кількість двохелектронних зв'язків, які може утворити атом елемента з іншими атомами, визначається числом неспарених електронів у його нормальному або збудженому стані. Наприклад, на валентних підрівнях атома фосфору [Ne]3s23p3 у нормальному стані є електронна пара на 3s-підрівні і три неспарені 3p -електрони:
Кількість двохелектронних зв'язків, які може утворити атом елемента з іншими атомами, визначається числом неспарених електронів у його нормальному або збудженому стані. Наприклад, на валентних підрівнях атома фосфору [Ne]3s23p3 у нормальному стані є електронна пара на 3s-підрівні і три неспарені 3p -електрони:

Символ Льюїса
Можна очікувати, що за рахунок трьох неспарених 3р-електронів фосфор утворить три двохелектронні зв'язки з іншими атомами і виникнуть сполуки типу PF3, РСlз, РН3 та ін. Проте на третьому енергетичному рівні атом фосфору має незаповнений (вакантний) 3d-підрівень. Внаслідок поглинання деякої кількості енергії атом фосфору збуджується, один s-електрон переміщується на вільний 3d-підрівень, виникають п'ять неспарених електронів і тепер може утворюватися п’ять двохелектронних зв'язків, яким відповідають речовини PF5, PCI55 та ін. Затрати енергії для переведення атомів у збуджений стан компенсуються енергією, яка виділяється під час утворення хімічного зв'язку.
 |
Наведений приклад ілюструє відхилення від правила октету. Між атомами фосфору і галогену виникають п'ять спільних електронних пар.
Виникнення різних збуджених станів атомів, що беруть участь в утворенні зв'язків, можливе тільки в разі переміщення електронів між підрівнями одного й того самого валентного енергетичного рівня.
Отже, у нормальному стані атом фосфору тривалентний, а у збудженому — п'ятивалентний.
Як нормальний, так і збуджений стан атомів можна передавати за допомогою електронно-конфігураційних формул і схем.
Як видно з даних табл.2.3.1, число неспарених електронів, що беруть участь в утворенні зв'язків, для атомів одного елемента може бути різним у нормальному і збудженому станах, а звідси — виникнення різних форм сполук елемента відповідно до різних валентних можливостей.
Таблиця 2.3.1.
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- IV. Відмінність злочинів від інших правопорушень
- V здатність до встановлення та підтримки гарних особистих стосунків і веденню етичного способу життя.
- V Такі негативні особистісні утворення, як самовпевненість і нерозвиненість автономії та ініціативи, обумовлюють неадаптивне старіння людини.
- Аверсивную терапію використовують, як правило, при лікуванні алкоголізму, нікотиновій залежності і деяких інших захворювань.
- Автономні утворення у зарубіжних державах
- Адміністративні зміни кінця 18-19 ст. та утворення нових архівів
- Алельні гени, знаходячись у гетерозиготному стані, не зливаються, не змінюють один одного і, не втрачаючи своєї індивідуальності, передаються в гамети.
- Амбівалентність відчуттів
- Амортизація інших необоротних матеріальних активів
- Аналіз витрат на підприємстві за їх елементами та статтями калькуляції.
- Аналіз при наявності одного обмеження
| <== попередня сторінка | | | наступна сторінка ==> |
| Деякі властивості актиноїдів | | | І в збудженому станах |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |