
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електроліз
Рівняння Нернста:
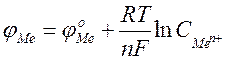 ,
,
де j0 – стандартний електродний потенціал; R – газова стала (8.314 Дж/моль´К); T – температура, К; n – заряд іона; F –число Фарадея (96500 Кл/моль); C – молярна концентрація (моль/л).
В більшості випадків відповідні розрахунки проводяться за стандартної температури (298 К). В такому випадку рівняння Нернста має вигляд:
 .
.
Однією з найважливіших характеристик гальванічного елемента є його електрорушійна сила (ЕРС). ЕРС дорівнює різниці потенціалів між позитивним та негативним полюсами гальванічного елемента.
Електрод, на якому відбувається процес окиснення, називається анодом (негативний полюс гальванічного елемента). Електрод, на якому відбувається процес відновлення, називається катодом (позитивний полюс гальванічного елемента). Природньо, що різниця потенціалів катода та анода є ЕРС.
ЕРС = jк – jА .
ЕРС пов’язана зі зміною енергії Гіббса і константою рівноваги реакції, що відбувається в гальванічному елементі, рівнянням:
DG = –nFE, lnK = (nF/ RT) E0.
Хімічні джерела струму – це пристрої, в яких енергія окисно-відновних реакцій перетворюється безпосередньо на електричну. Розрізняють три основних типи хімічних джерел струму: гальванічні елементи, акумулятори і паливні елементи.
В хімічних джерелах струму електрична енергія виробляється завдяки процесам, що відбуваються в електрохімічних системах. Ці процеси відбуваються самочинно.
Приклад 35.
Розрахувати ЕРС гальванічного елемента:
A(–)Zn½ZnSO4(C=0,01M)½½CuSO4(C=1,0M)½Cu(+)K
Напишіть рівняння реакції, що відбувається під час роботи гальванічного елемента.
Розв'язання.
Значення електродних потенціалів визначається за рівнянням Нернста:
j(Zn/Zn2+)=j°(Zn/Zn2+)+(0,059/2)lg0,01 = – 0,819 B.
j(Cu/Cu2+) =j°(Cu/Cu2+) + (0,059/2) lg1 = + 0,337 B.
ЕРС (Е) визначається різницею електродних потенціалів катода та анода:
E = j(K) – j(A) = 0,337 – (–0,819) = 1,156 B.
На аноді відбувається окислювальний процес: (A) Zn – 2e = Zn2+
На катоді відбувається відновний процес: (K) Cu2+ + 2e = Cu.
Сумарне рівняння реакції буде мати вигляд: Zn + Cu2+ = Zn2+ + Cu.
Якщо електричний струм пропустити через електрохімічну систему, в ній почнуть відбуватися процеси під дією електричної енергії. Ці процеси відбуваються не самочинно, а примусово: якщо зовнішнє джерело струму відключити, ці процеси припиняться. Сукупність таких процесів називають електролізом.
Електроліз – це сукупність процесів, що відбуваються на електродах при протіканні постійного електричного струму через розчин або розплав електроліту.
Анод, як і у випадку гальванічного елемента, це електрод, на якому відбувається процес окиснення. При електролізі він має позитивний знак.
Катод – електрод, на якому відбувається відновний процес, має негативний знак. Знаки катода та анода для процесів електролізу зворотні, у порівнянні зі знаками електродів в хімічних джерелах струму. При електролізі на електродах, з точки зору енергетики, проходять протилежні, у порівнянні з хімічними джерелами, процеси: в першому випадку – примусові, в другому – самочинні.
Катодні процеси. На катоді, в першу чергу, відновлюються катіони неактивних металів (тих, що в ряду стандартних електродних потенціалів стоять після водню). Катіони найбільш активних металів (від літію до алюмінію включно) не відновлюються на катоді. Метали середньої активності (після алюмінію – до водню) відновлюються на катоді разом з молекулами води:
2H2O+2e=H2+2OH–; Men++ne = Me°.
Анодні процеси. Процеси, що відбуваються на аноді, залежать як від електроліту, так і від матеріалу анода. Розрізняють розчинні (активні) аноди (Cu, Ag, Zn, Ni та інш.) і нерозчинні (інертні) (Pt, графіт). У випадку активних анодів має місце окиснення матеріалу анода:
Me – ne = Men+.
У випадку інертних анодів має місце окиснення молекул води або аніонів:
2H2O–4e=4H++O2; 2Hal––2e=Hal2,
де Hal – галоген.
На аноді найбільш ймовірним є процес, стандартний потенціал якого є найбільш негативним. У випадку інертного анода у більшості випадків окиснюються аніони безкисневих кислот (Cl–, Br–, I–, S2–). Якщо в розчині є тільки іони кисневмісних кислот ( і F–) то окиснюються молекули води.
Перший закон Фарадея:
Маса речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь розчин:
m = k Q ,
де Q – кількість електрики (Кл).
У випадку сталого струму( I = const ).
Q = I .t. m = k I t,
де t – час (с).
Другий закон Фарадея:
Читайте також:
- До фізико-хімічних методів очищення стічних вод належать: коагуляція, сорбція (абсорбція, адсорбція), мембранні методи, іонний, обмінні, електроліз, екстракція.
- Електроліз розплаву NaCl.
- Електроліз розчинів і розплавів
- Електроліз розчинів та розплавів.
- Електроліз – сукупність окисно-відновних процесів, що протікають на поверхні електродів при проходженні постійного електричного струму через розплав чи розчин електроліту.
- Електроліз.
- Електроліз.
- Електроустаткування електролізних виробництв.
- Однакові кількості електрики, що проходять крізь розчини різних електролітів, під час електролізу виділяють еквівалентні кількості речовин.
- Перевірка закону Фарадея для електролізу
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Однакові кількості електрики, що проходять крізь розчини різних електролітів, під час електролізу виділяють еквівалентні кількості речовин. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |