
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Класифікація неорганічних сполук
Усі неорганічні сполуки за складом поділяються на прості та складні. Серед простих речовин розрізняють метали та неметали (рис. 1).

Рис. 1. Класифікація неорганічних сполук
Метали складаються з атомів хімічних елементів – металів ( натрій Na, калій К, залізо Fe, магній Mg, срібло Ag тощо). Неметали складаються, як правило, з молекул хімічних елементів – неметалів (хлор Cl2, сірка S8, фосфор P4, кисень О2, азот N2 тощо). Метали та неметали мають різні хімічні властивості, що пояснюється електронною будовою їх атомів. Із властивостями цих простих сполук ми ознайомимося пізніше.
Складні речовини поділяються на такі класи: оксиди, основи, кислоти, солі. Поділ складних речовин на класи заснований на схожості хімічних властивостей.
Оксиди
Оксидами називаються речовини, що складаються з двох елементів, одним з яких є Оксиген зі ступенем окиснення (–2).
В оксидах атоми Оксигену сполучаються з атомами інших елементів і не зв’язані між собою:
C=O, O=C=O, O=B-O-B=O
Сполуки елементів з Оксигеном, у молекулах яких є зв’язок між атомами Оксигену, називають пероксидами (Н2О2 – гідроген пероксид Н-О-О-Н).
Пероксиди металів належать до класу солей, гідроген пероксид виявляє кислотні властивості.
Номенклатура. Загальне правило: у назві будь-якої складної неорганічної сполуки – спочатку вказують катіон, а потім аніон.
Назви оксидів за новою систематичною номенклатурою можна побудувати двома способами:
1)за допомогою числових префіксів (N2O5 – динітроген пентаоксид, Sb2O3 – дистибій триоксид, Na2O – динатрій оксид);
2)вказуючи ступінь окиснення елемента у формі катіона (N2O5 – нітроген(V) оксид, Sb2O3 – стибій(ІІІ) оксид, Na2O – натрій оксид).
Якщо елемент утворює лише один оксид або єдиний оксид у звичайній валентності, то назва його може складатися лише з назви елемента та слова “оксид”: BaO – барій оксид, B2O3 – бор оксид, К2О – калій оксид.
Сполуки Оксигену з більш електронегативним елементом Флуором треба називати флуоридами: OF2 – оксиген флуорид, O2F2 – діоксиген дифлуорид.
За хімічними властивостями оксиди поділяються на солетворні та несолетворні. Оксиди, які не утворюють солі, називаються несолетворними – NO – нітроген(ІІ) оксид, N2O – нітроген (І) оксид, SiO2 – силіцій(ІV) оксид. Несолетворних оксидів мало. Оксиди, які під час хімічних реакцій утворюють солі, є солетворними. До них належить більшість оксидів. Солетворні оксиди поділяються на основні, кислотні та амфотерні.
Основні оксиди. Основними називають оксиди, гідрати яких є основами. До таких належать лише оксиди металів: Магнію, Лантану, лужних (Li, Na, K, Rb, Cs), лужноземельних (Ca, Sr, Ba, Ra), а також усіх інших металів, нижчих ступенів окиснення (Cr(+2), Mn(+2), Pb(+2)).
Кислотні оксиди. Кислотними називаються оксиди, гідрати яких є кислотами. У зв’язку з цим кислотні оксиди ще називаються ангідридами кислот. До них належать оксиди неметалів, а також металів, які проявляють вищі ступені окиснення: SO2, SO3, CO2, CrO3, Mn2O7.
Амфотерні оксиди.Амфотерними називаються оксиди, які залежно від умов виявляють властивості основних і кислотних оксидів. До амфотерних належать оксиди деяких металів головних підгруп (Берилію, Алюмінію), а також оксиди багатьох металів побічних підгруп періодичної системи елементів з проміжними ступенями окиснення: BeO, Al2O3, ZnO, MnO2, Fe2O3.
Характеристика оксидів наведена далі (табл. 2).
Таблиця 2. Фізичні та хімічні властивості оксидів
| Властивість | Основний оксид | Кислотний оксид | Амфотерний оксид |
| Агрегатний стан | Твердий | Твердий, рідкий, газоподібний | Твердий |
| Тип хімічного зв’язку | Іонний | Ковалентний полярний | Іонно-ковалентний |
| Характер гідроксиду | Основа | Кислота | Виявляє властивості кислоти і основи |
| Взаємодія: з водою кислотами основами оксидами: основними кислотними амфотерними | Деякі: оксиди лужних та лужноземельних металів CaO+H2O=Ca(OH)2 Усі з утворенням солей Fe2O3+6HCl=2FeCl3+3H2O Не реагують Не реагують СаO+SiO2=CaSiO3 Li2O+Al2O3=2LiAlO2 | Більшість оксидів SO3+H2O=H2SO4 Не реагують З лугами 2NaOH+SiO2= =Na2SiO3+H2O Взаємодіють з утворенням солей CO2+CaO=CaCO3 Не реагують SO3+Al2O3=Al2(SO4)3 | Не реагують ZnO+2HCl=ZnCl2+H2O З лугами ZnO+2NaOH+H2O= =Na2[Zn(OH)4] ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 Не реагують |
Основи
Основаминазивають сполуки, які складаються з атома металу чи амонійної групи (NH4) та однієї чи декількох гідроксогруп – ОН -.
З погляду теорії електролітичної дисоціації основи– це електроліти, які під час дисоціації утворюють гідроксид – аніони. Наприклад: NaOH, Ca(OH)2, Mg(OH)2, La(OH)3.
Cлід зазначити, що ОН - - це гідроксид-іон, заряд його дорівнює (–1). Число гідроксид-іонів у основі визначається ступенем окиснення металу.
Номенклатура.Назви основ та амфотерних гідроксидів утворюють з назви катіона і слова “гідроксид”, вказуючи ступінь окиснення елемента або додаючи відповідні числові префікси. Якщо ж метал утворює тільки один гідроксид, то ступінь його окиснення не вказують: Fe(OH)2 – ферум(ІІ) гідроксид, або ферум дигідроксид; Аl(OH)3 – алюміній гідроксид, або алюміній тригідроксид.
Кислотність.Число гідроксогруп, зв’язаних з атомом металу, визначає
кислотність основи. Наприклад LiOH, NaOH – однокислотні основи; Са(OH)2, Ba(OH)2 – двокислотні; Cr(OH)3, Bi(OH)3 – трикислотні.
Фізичні властивості.Основи - це тверді речовини. За розчинністю у воді вони поділяються на дві групи: розчинні (луги) та нерозчинні. Лугами є гідроксиди лужних металів (елементів головної підгрупи І групи) і лужноземельних (елементів головної підгрупи ІІ групи, крім берилію та магнію).
Луги – це іонні сполуки. У вузлах кристалічних ґраток твердих лугів знаходяться іони металів і гідроксид-іони. В інших основах хімічний зв’язок має іонно-ковалентний характер.
Хімічні властивості основ.Характерні для основ хімічні реакції наведені в табл. 3. Лише розчинні у воді основи – луги - як сильні електроліти у водних розчинах практично повністю дисоціюють з утворенням гідроксид-іонів:
NaOH«Na+ + OH-.
Тому вони мають деякі загальні властивості, обумовлені наявністю гідроксид-іонів, наприклад впливають на забарвлення багатьох кислотно-основних індикаторів.
Нерозчинні у воді основи як слабкі електроліти не змінюють колір індикаторів, не взаємодіють з кислотними та амфотерними оксидами, а також солями. Дуже слабко дисоціюють на іони. Невеликої кількості гідроксид-іонів, які містяться в насичених розчинах основ, недостатньо для забезпечення перебігу зазначених реакцій. Нерозчинні у воді основи дають тільки дві реакції.
Амфотерні гідроксиди – це гідроксиди, які виявляють основні та кислотні властивості залежно від умов, тобто від природи другого компонента, який бере участь у кислотно-основній взаємодії.
До амфотерних гідроксидів належать гідроксиди деяких металів головних підгруп (Берилію, Алюмінію), а також багатьох металів побічних підгруп періодичної системи елементів проміжних ступенів окиснення: Be(OH)2 , Al(OH)3, Zn(OH)2,Cr(OH)3.
Тип зв’язку між атомами металу та гідроксогрупами – ковалентний. Усі амфотерні гідроксиди – слабкі електроліти. Оскільки полярність ковалентних зв’язків Ме–О і О–Н у їх молекулах близька, амфотерні гідроксиди можуть дисоціювати і як основа, і як кислота:
Al(OH)3 « [Al(OH)2]+ + OH- « [Al(OH)]2+ + 2OH- « Al3+ + 3OH-;
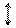 H3AlO3 « 3H+ + AlO
H3AlO3 « 3H+ + AlO  « HAlO2 + H2O « H+ + AlO
« HAlO2 + H2O « H+ + AlO 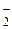 + H2O.
+ H2O.
Амфотерні гідроксиди не змінюють забарвлення індикаторів.
Читайте також:
- II. Класифікація видатків та кредитування бюджету.
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Основні засоби
- II.3. Основні способи і прийоми досягнення адекватності
- V. Класифікація і внесення поправок
- V. Класифікація рахунків
- VII. ОСНОВНІ ЕТАПИ РОЗВИТКУ УКРАЇНСЬКОЇ КУЛЬТУРИ У ХХ ст.
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- А .Маршалл - основоположник неокласичної теорії.
- А. Структурно-функціональна класифікація нирок залежно від ступеню злиття окремих нирочок у компактний орган.
- Абстрактні класи
- Адвокатура в Україні: основні завдання і функції
| <== попередня сторінка | | | наступна сторінка ==> |
| Треба вміти | | | Кислоти |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |