
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Дисоціація води. Іонний добуток води. Водневий показник
Чиста вода є слабким електролітом, який незначною мірою проводить електричний струм. При 22°С її ступінь електричної дисоціації дорівнює 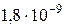 , тобто дисоціює тільки одна з 555∙106 молекул води. Однією із причин цього є те, що дисоціація пригнічується дією водневих зв’язків, типових для води. Дисоціацію води можна записати так:
, тобто дисоціює тільки одна з 555∙106 молекул води. Однією із причин цього є те, що дисоціація пригнічується дією водневих зв’язків, типових для води. Дисоціацію води можна записати так:
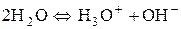 .
.
Для спрощення і зручності рівняння записують в такому вигляді:
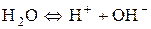 .
.
Застосувавши до цієї рівноваги закон діючих мас, маємо:
 , або
, або  ,
,
де К – константа електричної дисоціації води, вона дорівнює 1,8∙10-16.
Оскільки ступінь дисоціації води дуже маленька величина, то практично [H2O]=const (кількість дисоційованих молекул не враховується) і тоді
 .
.
Константа  називається іонним добутком води.
називається іонним добутком води.
Оскільки  , то при 220С
, то при 220С 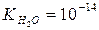 .
.
Таким чином, 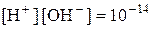 .
.
Значення  є постійною величиною за даної температури.
є постійною величиною за даної температури.
В умовах кімнатної температури нейтральні розчини мають однакову концентрацію: 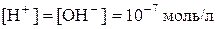 та
та 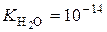 . Таке саме значення мають при тій же самій температурі й розведені водні розчини кислот і основ. Тому, якою б не була концентрація іонів Гідрогену, концентрація гідроксид-іонів не буде мати нульового значення або навпаки. Це дає можливість розраховувати концентрацію [H+] або[OH−], якщо одна з цих величин відома:
. Таке саме значення мають при тій же самій температурі й розведені водні розчини кислот і основ. Тому, якою б не була концентрація іонів Гідрогену, концентрація гідроксид-іонів не буде мати нульового значення або навпаки. Це дає можливість розраховувати концентрацію [H+] або[OH−], якщо одна з цих величин відома:
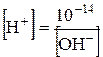 та
та 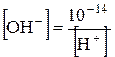 .
.
Наприклад, концентрація іонів Гідрогену в 5×10-3 М розчину натрій гідроксиду дорівнює
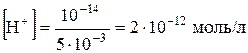 .
.
Однак записувати концентрацію іонів [H+] та [OH−], застосовуючи від’ємний степінь не зовсім зручно. Тому кислотні властивості розчинів датський біохімік Серенса запропонував характеризувати величиною водневого показника рН, який визначається співвідношенням
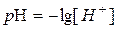 ,
,
або 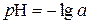 , (31)
, (31)
оскільки експериментально в розчині визначають не концентрацію іонів гідрогену, а їх активність (a=f C).
Рівняння (31) можна записати в такому вигляді:
 ,
,
де 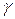 − коефіцієнт активності іонів Гідрогену, значення якого в розведених розчинах наближається до одиниці. Тоді
− коефіцієнт активності іонів Гідрогену, значення якого в розведених розчинах наближається до одиниці. Тоді 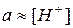 .
.
Оскільки концентрація іонів Гідрогену може змінюватися в межах іонного добутку, то рН змінюється в інтервалі від 0 до 14.
У нейтральному розчині 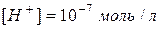 ;
;  .
.
У кислому розчині  ;
;  . Так, для
. Так, для  М розчину
М розчину 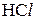
 ;
; 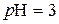 . Для розчину
. Для розчину  тієї ж концентрації
тієї ж концентрації
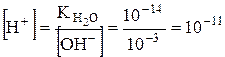 ;
;  .
.
Таким чином, кислий розчин  ;
;
нейтральний розчин 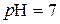 ;
;
лужний розчин 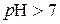 .
.
Розчини, значення рН яких знаходяться в інтервалі від 0 до 3, належать до сильнокислих; при рН = 4…6 – до слабкокислих. Слабколужні розчини мають рН = 8…10, а сильнолужні – рН = 11…14.
Розчини, в яких 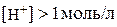 , мають від’ємне значення рН. Так, якщо
, мають від’ємне значення рН. Так, якщо  , то
, то  .
.
При 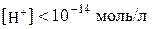
 . Якщо
. Якщо 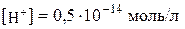 , то
, то  . Вивчення рН розчинів має велике практичне значення в хімії, біології, медицині, харчовій промисловості, сільському господарстві та ін.
. Вивчення рН розчинів має велике практичне значення в хімії, біології, медицині, харчовій промисловості, сільському господарстві та ін.
Читайте також:
- IV група- показники надійності підприємства
- Абсолютні показники фінансової стійкості
- Абсолютні показники фінансової стійкості та її типи
- Абсолютні статистичні показники.
- Абсолютні та відності показники результатів діяльності підприємства.
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Алгоритм розрахунку основних фінансових показників (коефіцієнтів)
- Аналіз відносних показників прибутковості (рентабельності) роботи банку
- Аналіз динаміки узагальнюючих показників і факторів
- Аналіз макроекономічних показників
- Аналіз основних техніко-економічних показників діяльності підприємств будіндустрії
- Аналіз показників валового прибутку і собівартості реалізованої продукції
| <== попередня сторінка | | | наступна сторінка ==> |
| Добуток розчинності | | | ПІДСУМКИ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |