
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Білковий обмін: загальні відомості
Білковий обмін
Одержані з їжею білки підлягають повному гідролізу в шлунково-кишковому тракті до амінокислот, які всмоктуються та з кровотоком розподіляються в організмі. 8 з 20 білкових амінокислот не здатні синтезуватися в організмі людини – це незамінні амінокислоти, що повинні надходити з їжею.
Через кишечник і також через нирки в невеликих кількостях організм постійно втрачає білок, тому щодобово необхідно отримувати з їжею не менше 30 г білка.
Фізіологічний мінімум ‑ кількість білка в раціоні, необхідна для підтримування балансу азоту в організмі. В індустріальних країнах вміст білка в їжі найчастіше значно перевищує норму. Амінокислоти не запасаються в організмі. При надлишковому надходженні амінокислот в печінці окислюється або використовується до 100г амінокислот за добу. Азот, що міститься в них, перетворюється на сечовину і в такій формі виділяється з сечею, а вуглецевий скелет використовується в синтезі вуглеводів, ліпідів або окислюється з утворенням АТФ.
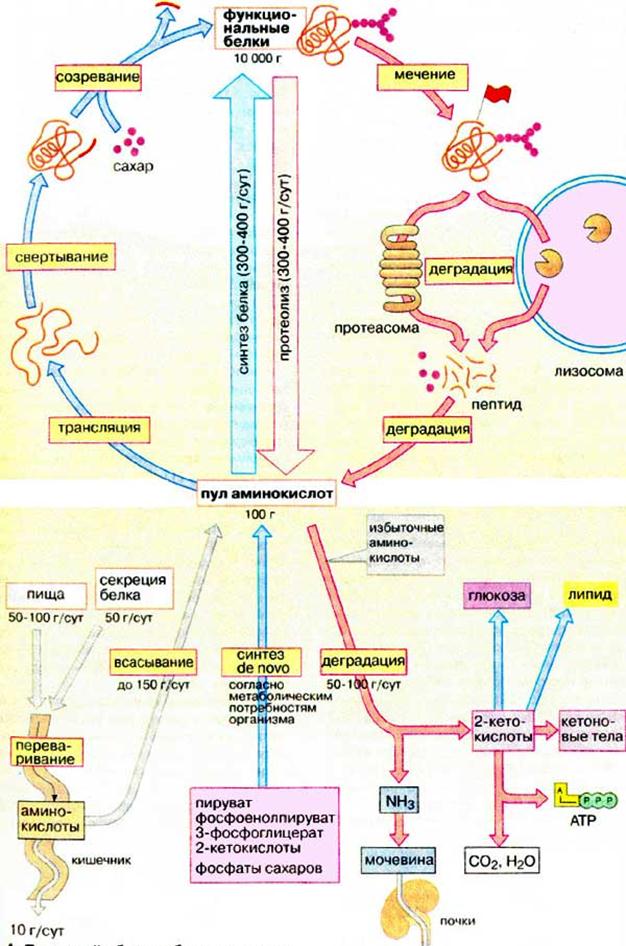
Вважають, що в організмі дорослої людини щодобово розщеплюється до амінокислот 300-400г білка (протеоліз). Одночасно приблизно така ж сама кількість амінокислот включається до утворених молекул білків (білковий біосинтез).. Високий обіг білка в організмі необхідний тому, що багато білків відносно недовговічні: вони починають оновлюватися через декілька годин після синтезу, а біохімічний напівперіод оновлення складає 2-8 днів. Навпаки довговічними є структурні білки, гістони, гемоглобін або компоненти цитоскелету.
Ключеві ферменти проміжного обміну оновлюються через декілька годин після синтезу. Поєднання процесів розщеплення та ресинтезу дозволяє клітинам швидко регулювати рівень і активність найбільш важливих ферментів відповідно з метаболічними потребами. Майже всі клітини здатні здійснювати біосинтез білків (на схемі наверху зліва). Побудова пептидного ланцюга шляхом трансляції проходить у рибосомах. Однак, активні форми більшості білків виникають тільки після ряду подальших кроків. По-перше за допомогою допоміжних білків шаперонів повинна утворитися біологічна активна конформація пептидного ланцюга (згортання). При посттрансляційному дозріванні у багатьох білках видаляються частини пептидного ланцюга або приєднуються додаткові групи, наприклад олігосахариди або ліпіди. Такі процеси відбуваються в ендоплазматичному ретикулумі та в апараті Гольджи. Потім, білки повинні транспортуватися у відповідну тканину або орган (сортирування).
Внутришньоклітинне розщеплення білків (протеоліз) відбувається частково в ліпосомах. Крім того, в цитоплазмі наявні органели ‑ протеасоми, в яких підлягають руйнуванню неправильно згорнуті або денатуровані білки. Такі молекули ідентифікують за допомогою спеціальних маркерів.
Етапи розщеплення білків:
І. Шлунок(початок розщеплення білків): утворюється суміш пептидів і молекул білків, що не розщепилися.
Ферменти:
1пепсин (протеолітичний фермент шлункового соку), утворюється в головних клітинах залоз слизової оболонки шлунка в неактивній формі у вигляді проферменту – пепсиногену, який перетворюється на пепсин під дією шлункового соку, а також під впливом пепсину (аутокаталітичний процес активації).Розщеплює внутрішні пептидні зв’язки білка, продукти гідролізу – пептони, або пептиди;
1хімозин (у немовлят і молодих тварин, що харчуються тільки материнським молоком), специфічно розщеплює основний білок молока – казеїноген, перетворюючи його на казеїн.
Роль НСІ:
a забезпечує необхідну кислотність для каталітичної дії ферментів (рН = 1,5 – 2,5);
a каталізує процеси перетворення пепсиногену на пепсин;
a каталізує процеси набухання і розпушування білків (полегшує каталітичну дію ферментів;
a запобігає розвитку в шлунку процесів гниття та бродіння (шлунковий сік містить 0,4-0,5% вільної соляної кислоти).
ІІ. Тонка кишка(розщеплення білків і пептидів до амінокислот)
Перетравлювання білків і пептидів відбувається:
1у порожнині кишок (піддаються гідролітичному розщепленню в основному молекули білка);
1на поверхні слизової оболонки кишок (пристінне перетравлювання) – гідролітичне розщеплення молекул пептидів з різною кількістю залишків амінокислот.
Ферменти:
³ трипсин (фермент соку підшлункової залози), виділяється в неактивній формі у вигляді трипсиногену. Фермент кишкового соку ентерокіназа перетворює трипсиноген у трипсин, іони кальцію (активація процесу). Оптимальна активність при рН = 7 – 8, діє на білки, що не розщепилися, і відносно високомолекулярні пептиди.
³ хімотрипсин виділяється соком підшлункової залози в неактивні йформі у вигляді хімотрипсиногену (циклічний полі пептид), гідролізує пептидні зв’язки, утворені карбоксильнми групами амінокислот фенілаланіну, тирозину, триптофану, метіоніну та лейцину. Оптимальна активність при рН = 7 – 8.
³ екзопептидази (амінопептидази, карбоксипептидази, дипептидази), належать до металоферментів, тобто активуються іонами Мg2+, Mn2+, Co2+, Zn2+ (забезпечують утворення фермент-субстратного комплексу).
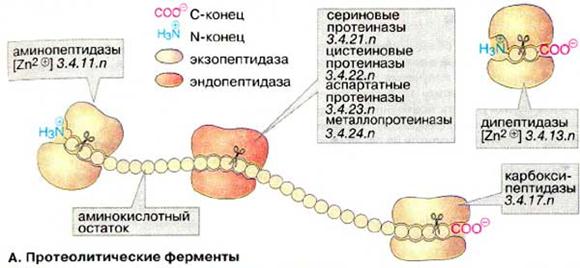
| Карбоксипептидазикаталізують процес відщеплення амінокислотних залишків з С-кінця пептичного ланцюга, активуються трипсином. Амінопептидазикаталізують відщеплення N-кінцевих залишків амінокислот за умови вільної NH2-групи. Дипептидазирозщеплюють дипептиди до амінокислот. |
| 
| 
| ||
| Карбоксипептидаза | Активація трипсиногену | Активний центр трипсину | ||
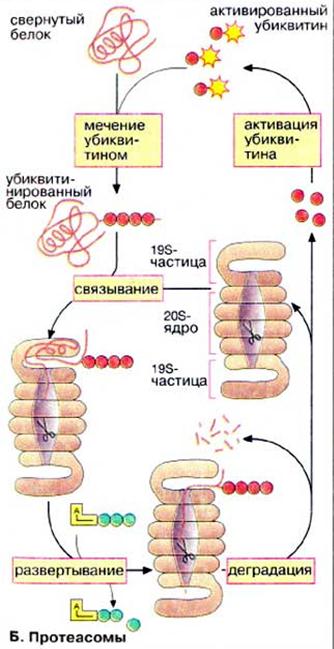
| Велика група протеіназ містить в активному центрі серин: ферменти травлення трипсин, хімотрипсин і еластаза, фактори згортання крові, фермент плазмін і його активатори. Панкреатичні протеінази виділяються у вигляді проферментів (зимогенів). Активація таких ферментів основана на протеолітичному розщепленні. Процес активації показаний на прикладі трипсиногену, попередника трипсину. Процес активації починається з відщеплення N-кінцевого гексапептиду ентеропептидазою («ентерокіназою»), специфічною сериновою протеіназою, яка локалізована на мембранах кишкового епітелію. Продукт розщеплення (β-трипсин) ферментативно активний і розщеплює наступну молекулу трипсиногену в місцях, позначеним червоним кольором (аутокаталітична активація). Залишок серину за участі залишків гістидину та аспартату атакує зв’язок (червона стрілка). Частина пептидного субстрату розміщена в С-кінцевій стороні від залишку лізину, боковий ланцюг якого під час каталізу фіксується в спеціальному «кармані» ферменту. Протеасоми Оскільки функціональні білки клітини повинні бути захищені від передчасного протеолізу, частина протеолітичних ферментів клітини вміщена в ліпосоми. Інша система деградації білків локалізована в цитоплазмі. Вона складається з великих білкових комплексів, протеасом. Протеасоми містять бочковидне ядро з 28 субодиниць. Протеолітична активність (на схемі показана у вигляді ножиць) локалізована у внутрішньому 20S-ядре. С торців бочки запираються складно побудованими 19S-часточками, як контролюють доступ в ядро. Білки, які будуть розщеплюватися в протеасомі (наприклад, ті, що містять помилки транскрипції або старі молекули), маркуються шляхом ковалентного зв’язування білком убіквітіном. Убіквітин активований завдяки наявності тіолскладного зв’язку. Помічені убіквітином молекули розпізнаються 19S-часточками з використанням АТФ і потрапляють в ядро, де відбувається їх деградація. Убіквітин не руйнується та після активації використовується знову. | |||
 | |||||
 |  | ||||

Читайте також:
- II. ЗАГАЛЬНІ ПОЛОЖЕННЯ.
- IX. Відомості про військовий облік
- IX. Відомості про військовий облік
- V Практично всі психічні процеси роблять свій внесок в специфіку організації свідомості та самосвідомості.
- Білковий обмін
- Біографічні відомості
- Боротьба з проявами національної самосвідомості
- Вальниці ковзання. Загальні відомості
- Види правосвідомості
- Вимір дохідності та загальні підходи до оцінки ефективності управління інвестиційним портфелем.
- ВИМОГИ ДО ОБ'ЄМНО-ПЛАНУВАЛЬНИХ РІШЕНЬ ГАРАЖІВ Загальні вимоги
| <== попередня сторінка | | | наступна сторінка ==> |
| Лекція №4. Обмін білків | | | Орнітин, лізин триптофан тирозин |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |