
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині
Мета роботи: визначити концентрацію галогенід-іонів при спільній їх присутності у розчині.
Визначення галогенідів проводять методом осадового титрування розчином арґентум нітрату (розділ 4.2.3.1 пункт 1) ).
При титруванні суміші галогенідів першою в осад випадає менш розчинна сполука – йодид срібла, потім хлорид срібла ( 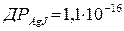 ;
;  ). Концентрація іонів арґентуму [Ag+], необхідна для утворення осаду AgJ, дорівнює
). Концентрація іонів арґентуму [Ag+], необхідна для утворення осаду AgJ, дорівнює  . Поступово протягом титрування концентрація
. Поступово протягом титрування концентрація  зменшується. Таким чином концентрація [Ag+], необхідна для утворення осаду, збільшується.
зменшується. Таким чином концентрація [Ag+], необхідна для утворення осаду, збільшується.
Утворення хлориду срібла почнеться, коли 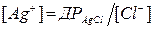 тобто одночасне утворення двох осадів почнеться за умови, коли:
тобто одночасне утворення двох осадів почнеться за умови, коли:
 .
.
Виходячи з наведеної рівності можна розрахувати за якої концентрації йодид-іонів починається утворення осаду арґентум хлориду. Якщо концентрація хлорид-іонів у розчині складає порядку 0,1 моль/л, то
 .
.
Прийнято, що іон практично повністю осаджений при концентрації його в розчині порядку 10–5–10–6 М. Таким чином досягається повнота осадження йодид-іонів та помилка визначення при 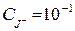 M складає 10–2%.
M складає 10–2%.
Потенціометричне титрування арґентум нітратом проводять з срібним індикаторним електродом на фоні електроліту 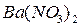 , який додають для коагуляції осадів і підтримки постійної іонної сили розчину. Електрод порівняння (каломельний або хлорсеребряний) занурюють в додатковий стаканчик і сполучають з досліджуваним розчином за допомогою сольового містка, заповненого KNO3. На кривій потенціометричного титрування спостерігають два стрибки титрування (пункт 1) розділ 4.2.3.1): I – точка еквівалентності для йодиду; II – точка еквівалентності для хлориду.
, який додають для коагуляції осадів і підтримки постійної іонної сили розчину. Електрод порівняння (каломельний або хлорсеребряний) занурюють в додатковий стаканчик і сполучають з досліджуваним розчином за допомогою сольового містка, заповненого KNO3. На кривій потенціометричного титрування спостерігають два стрибки титрування (пункт 1) розділ 4.2.3.1): I – точка еквівалентності для йодиду; II – точка еквівалентності для хлориду.
Обладнання та реактиви:
1. Потенціометр.
2. Срібний та хлорсрібний (або каломельний) електроди.
3. Розчин суміші KJ та KCl; 0,1М розчин 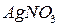 .
.
4. 10% розчин 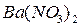 .
.
5. Бюретка, мірний циліндр, хімічні стакани на 100 мл.
6. Магнітна мішалка та сольовий місток.
Методика виконання роботи
До отриманого розчину суміші солей галогенідів, що аналізують, додають приблизно 25 мл розчину фонового електроліту барій нітрату. Занурюють магнітну мішалку та опускають індикаторний електрод – срібну дротину – таким чином, щоб він не торкався мішалки. За допомогою сольового містка з’єднують досліджуваний розчин з електродом порівняння – каломельним електродом. Титрують 0,1М розчином азотнокислого срібла при постійному перемішуванні. Після кожного додавання реагенту (0,2 мл) вимірюють ЕРС. Перший стрибок титрування (значна зміна потенціалу) відповідає закінченню титрування йодид-іонів. При цьому відбувається зміна знаку рівноважного потенціалу, тобто переполюсовка срібного електроду. Продовжують титрування та спостерігають другий стрибок, що відповідаю закінченню титрування хлорид-іонів. Після стрибка додають ще 3–4 порції титранта. Результати вимірювання ЕРС заносять в таблицю, будують криві титрування та визначають точки еквівалентності, обчислюють вміст йодид- і хлорид-іонів за формулами:
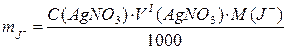 ;
;
 ,
,
де 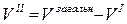 .
.
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Електрогравіметричний метод |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |