
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електроди.
Потенціометричний метод виміру рН заснований на вимірі електродного потенціалу, що виникає при опусканні в аналізований розчин спеціальної електродної системи вибірної дії. ЕРС електродної системи залежить від активності іонів водню в розчині. Таким чином, електродна система завжди складається із двох електродів: вимірювального, потенціал якого функціонально пов'язаний з концентрацією водневих іонів у розчині, і порівняльного, або допоміжного, потенціал якого в процесі виміру повинен залишатися строго постійним, що є одним з основних вимог, пропонованих до порівняльних електродів.
У якості вимірювальних широко використовуються скляні й; сурм'яні електроди. Відомі також водневі, та деякі інші, але у вимірювальній практиці вони застосовуються порівняно рідко. У якості допоміжних, поширені каломельні й хлорсерібряні електроди; інші типи практично не застосовуються.

Рис. XI.11.Скляний вимірювальний електрод
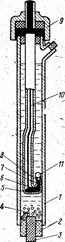
Рис. XI-12. Каломельний порівняльний електрод
Корпус 2 універсальні скляні електроди (мал. XI.11) виготовлений з каліброваної скляної трубки. До одного кінця її приварюється мембрана зі спеціального електродного скла, що є активною частиною електрода. Мембрана може виготовлятися різної форми (кулястої, списоподібної, голчастої, плоскої) залежно від призначення електрода. Внутрішня частина корпуса заповнюється 0,1 % розчином соляної кислоти з невеликою кількістю кристалів хлориду срібла. У розчин поринає контактний електрод 3 (хлорсерібряний або каломельний), від якого відходить вихідний провідник 4 з кабельним наконечником 5, щовідводить потенціал до вимірювального приладу. Для герметизації на верхню частину електрода надітий поліетиленовий ковпачок.
Для виготовлення чутливих скляних мембран застосовуються різні сорти скла, що містять домішки деяких одновалентних металів (Na, Li, К та ін.), які під дією виникаючих електростатичних сил вириваються з вузлів кристалічних силікатних ґрат стекла й переходять у розчин, а їхні місця займають більш активні катіони водню (Н+); які перейшли з розчину. У цей час техніка одержання електродних стекол досягла високого ступеня досконалості й дозволяє виготовляти електроди, потенціал яких не залежить від присутності окислювачів і відновлювачів у розчинах які, не піддані поляризації, забрудненню (отруєнню) і т.п. Скляні електроди зі спеціальних, стекол можуть працювати при температурах до 100° С і вище. Випускається більша номенклатура скляних електродів для використання у різних середовищах, у заглибних і проточних вимірювальних перетворювачах і т.д. Є конструкції електродів, призначені спеціально для застосування у виробництві харчових продуктів (молока й кисломолочних продуктів, рослинних масел, опари, тіста й т.д.).
Сурм'яні вимірювальні електроди виготовляються з металевої сурми у вигляді стрижня або із платинового дроту, на яку нанесений шар сурми. Електродний потенціал виникає на границі металевої сурми і її окису, що утвориться на поверхні металу. Є спеціальні самоочисні сурм'яні електроди, призначені для контролю кислотності тіста, опар й інших сильно в’язких харчових продуктів.
Корпус каломельного електрода (мал. XI. 12) являє собою скляну трубку. Нижній її кінець закривається гумовою пробкою 2 з напівпроникним набиванням 5, через яку здійснюється контакт із аналізованим розчином. Усередину трубки заливається насичений розчин хлориду калію 4 і вставляється трубка 5, заповнена в нижній частині ртуттю 6, каломелем 7 (хлорид ртуті Hg2Gb) і кристалами хлориду калію 8. Кінець внутрішньої трубки закривається ватяним або азбестовим тампоном 11. Електричний вивід від ртуті до вимірювальної схеми здійснюється за допомогою проведення 10. Зверху скляна трубка-корпус закритий ковпачком 9. Існує велика кількість конструкцій каломельних електродів, застосовуваних у різних умовах виміру рН. Однак у харчовій промисловості ці електроди повинні застосовуватися досить обережно через наявність у них ртуті, Хлорсерібряний допоміжний електрод являє собою срібний стержень, на поверхню якого нанесений шар малорозчинної солі AgCl.
Електричне коло вимірювального перетворювача (осередку) для виміру рН розчинів (мал. XI. 13) складається з вимірювального скляного електрода з допоміжним внутрішнім електродом, що служить для створення електричного кола, і зовнішнього допоміжного електрода 2, щоздійснює контакт з контрольованим розчином. При зануренні електродів в аналізований розчин між поверхнею скла кульки й розчином відбувається обмін іонами, у результаті якого одновалентні іони металів, що втримуються в електродному склі, переходять у розчин і заміщаються іонами водню з розчину. Внаслідок такої взаємодії між поверхнею скла й контрольованим розчином виникає різниця потенціалів Ех (мВ), обумовлена активністю іонів водню в розчині:
Ex = E0 + (2,3RT/F)lga (XI. 18)
де Еа -* нормальний потенціал, В; активність іонів водню у розчині;
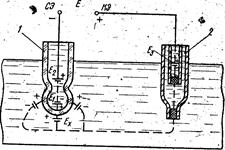
Рис. XL 13. Функціональна схема електричного кола вимірювального перетворювача рН розчинів
Таким чином, вимірюючи потенціал скляного електрода, зануреного в аналізований розчин, можна визначити рН.
Електрорушійна сила Е, щовиникає в електродній системі, дорівнює алгебраїчній сумі ЕРС, що виникає на внутрішній поверхні скляного електрода Еи ЕРС контактних електродів Еч і Е3 і ЕРС, що виникає на зовнішній поверхні скляного електрода Ех. Таким чином, сумарна ЕРС:
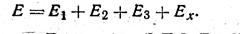 XI. 19)
XI. 19)
Величини ЕРСне залежать від складу аналізованого середовища ич змінюються лише зі зміною температури. Величина ЕРС Ех, щовиникає на зовнішній поверхні скляного електрода, визначається значенням рН і температури аналізованого розчину. Таким чином, вимірявши ЕРС, що розвивається вимірювальної потенціометричним осередком, можна виміряти величину рН, що характеризує властивість аналізуючого розчину. При цьому завжди варто мати на увазі, що ЕРС електродного осередку залежить як від величини рН, так і від температури розчинів. Розглянемо характеристику електродної системи з погляду впливу на неї обох факторів - величини рН і температури. Залежність ЕРС електродної системи від рН характеризується крутістю її характеристики й визначається в першу чергу властивостями скляного електрода.
Таким чином, зміна температури розчину змінює крутість характеристики й тим самим ЕРС електродної системи. Звичайно допоміжні електроди й розчини, що заповнюють, вибираються з таким розрахунком, щоб при зміні температури сумарна зміна ЕРС електродної системи було мінімальним, а при деякому значенні рН розчину рівнялося б нулю. Вимірювальні схеми. Величина рН контрольованого розчину при даній температурі визначається по ЕРС електродної системи, вимірюваної за допомогою відповідного електровимірювального приладу. Відомо велика кількість вимірювальних схем, застосовуваних для контролю рН розчинів. Однак більшість із них може бути віднесене до однієї із двох груп: схеми безпосереднього виміру ЕРС зі споживанням струму; компенсаційні схеми виміру ЕРС. При виборі тої або іншої схеми варто мати на увазі, що електродні системи зі скляними електродами мають надзвичайно більший внутрішній опір, що досягає сотень, а іноді й тисяч мегаОм, що пред'являє до вимірювальних схем ряд серйозних вимог.
Метод безпосереднього виміру ЕРС зі споживанням струму застосовується порівняно рідко в тих випадках, якщо можна використати прилад, внутрішній опір якого не менш чим в 100 разів вище опору електродів, якщо прилад досить чутливий і якщо струм, що протікає у вимірювальному ланцюзі, менше струму поляризації електродів.
Відомо кілька варіантів використання методу безпосереднього виміру ЕРС. Електродної системи, які покладені в основу малогабаритних переносних приладів, що випускаються, лабораторного типу, застосовуваних у тому випадку, коли не потрібна висока точність виміру (не вище ±0,1 рН). Саме широке поширення одержали вимірювальні прилади для виміру рН, засновані на компенсації вимірюваної ЕРС напругою відомої величини. У більшості приладів, що працюють по компенсаційному принципі, компенсація вимірюваної ЕРС здійснюється з використанням мостових схем, що забезпечує простоту настроювання й регулювання, порівняну легкість введення температурних виправлень.
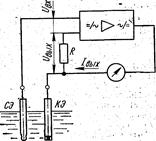
У схемі виміру з динамічною компенсацією (мал. XI. 14) міст живляться від джерела постійного стабілізованої напруги. Нульовий індикатор НІ (підсилювач) фіксує різниця UBX між ЕРС вимірювального осередку Ех і компенсаційною напругою UK у діагоналі мосту абі виробляє сигнал розбалансу, за допомогою якого через реверсивний електродвигун РД переміщенням движка компенсаційного змінного резистора Rp – здійснюється компенсаційне балансування схеми.
Подібна схема виміру рН із динамічної, компенсацією ЕРС багато в чому подібна з вимірювальними схемами автоматичних електронних потенціометрів, використовуваних для виміру температури в комплекті з термоелектричними перетворювачами температури. Принциповою відмінністю схем рН-метрів є наявність високоомного входу електронного підсилювача вимірювальної й компенсаційної схеми.
Підсилювачі постійного струму, застосовувані у вимірювальних схемах рН-метрів, виконуються або по схемах прямого посилення, або із застосуванням перетворення вхідного сигналу в змінну напругу, його посилення й зворотнього перетворення на виході. У високоомній рН-метрії переважне; поширення одержали електромеханічні віброперетворювачі. Недоліками цих приладів є складність кінематичної схеми й наявність реохорда з контактним повзунком, що є джерелом додаткових погрішностей.

Рис. XI.14. Принципова електрична схема Виміру рН із динамічною компенсацією
Рис, XI.15. Принципова електрична схема виміру рН із статичною компенсацією
Недоліками цих приладів є складність кінематичної схеми й наявність реохорда з контактним повзунком, що є джерелом додаткових погрішностей.
Більше зручними і надійними є схеми зі статичною компенсацією й використанням глибокого негативного зворотнього зв'язка по струму, у яких сполучаються переваги компенсаційних схем виміру й схем з безпосередній відліком. У схемі зі статичною компенсацією (мал. XI.15) електрорушійна сила Лх, щорозвивається електродною системою, рівняється зі спаданням напруги на опорі (резисторі) R, через яке, протікає струм виходу, що виходить після підсилювача. На вхід підсилювача подається різниця між напругою Ех і спаданням напруги на опорі R. Отже, вхідна напруга:
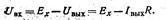 (XI.21)
(XI.21)
Напруга за допомогою віброперетворювача перетвориться в змінну напругу, підсилюється та потім знову перетвориться в постійне, котре управляється струмом Івих на кінцевому каскаді підсилювача. Таким чином, якщо позначити коефіцієнт підсилення підсилювача по постійному струмі, то можна записати:
 (XI.22)
(XI.22)
| <== попередня сторінка | | | наступна сторінка ==> |
| Потенціометричні аналізатори. | | | ОСНОВНІ ВІДОМОСТІ ПРО ВИМІР СОСТАВА ГАЗІВ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |