
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Концентрацією розчину називається спосіб вираження розмірними одиницями вмісту розчиненої речовини в розчині.
Чисельне вираження складу розчинів
Існують різні способи вираження кількісного складу розчинів. Склад розчину може виражатися за допомогою безрозмірних одиниць (часток або відсотків) і розмірних одиниць — концентрації.
Розведені розчини мають низький вміст розчиненої речовини 1 структуру, близьку до структури розчинника. Концентровані розчини мають високий вміст розчиненої речовини і структуру, близьку до структури розчиненої речовини.
Масова частка розчиненої речовини ω (омега) — це безрозмірна фізична величина, рівна відношенню маси розчиненої речовини до загальної маси розчину:
ω = т (речовини) / т (розчину),
де ω — масова частка розчиненої речовини.
Масову частку розчиненої речовини звичайно виражають у частках одиниці або у відсотках:
ω = т (речовини) ∙ 100% / т (розчину).
П р и к л а д. Масова частка розчиненої речовини — сульфатної кислоти — у воді дорівнює 0,08 або 8%. Це означає, що в розчині масою 100 г міститься 8 г сульфатної кислоти і 100 — 8 = 92 г води.
Мольна частка — це безрозмірна фізична величина, яка дорівнює відношенню кількості розчиненої речовини (або розчинника) до суми кількостей усіх речовин, що складають розчин.
П р и к л а д. Якщо розчин містить одну розчинену речовину в кількості υ1 моль, то мольна частка розчиненої речовини
N1 = υ1 / (υ1 + υ2),
де υ2 – кількість молів розчинника в розчині.
Мольна частка розчинника
N2 = υ2 / (υ1 + υ2).
Молярна концентрація, або молярність, — це відношення кількості розчиненої речовини (υ, моль) до об’єму розчину (V, л або дм3):
М = υ/ V.
Молярна концентрація має розмірність моль/л (або моль/дм3). Молярність позначається См або (після чисельного значення молярності) М.
Розчин, у 1 л якого міститься 1 моль розчиненої речовини, називається одномолярним, або просто молярним.
П р и к л а д. Двомолярний розчин натрій хлориду позначається як 2М NaCl або См (NaCl) = 2 моль/л.
Молярна концентрація еквівалента (інші назви: еквівалентна концентрація, нормальність)— це відношення еквівалентної кількості розчиненої речовини до об’єму розчину. Молярну концентрацію еквівалента виражають у молях еквівалента на літр і позначають літерою «н», а в формулах для обчислення — Сек. Досить часто хіміки користуються такою термінологією: 1н – однонормальний розчин, 0,5н – напівнормальний розчин, 0,1н – децинормальний розчин, 0,01н – сантинормальний розчин і т. д.
П р и к л а д. Двонормальний розчин натрій сульфату позначається як 2н Nа2SO4 або Сек (Nа2SO4) = 2 моль екв/л.
Кількісний склад розчину можна виражати через моляльність — число молів розчиненої речовини, що міститься в 1000 г розчинника.
Іноді (на виробництві) склад розчину виражають через його густину. Для розчину кожної речовини, що має певну густину, характерний певний вміст цієї речовини. Густину розчину наближено визначають спеціальним приладом — ареометром. Знаючи густину розчину, за спеціальними таблицями можна встановити масову частку розчиненої речовини у відсотках.
Склад розчину можна також виражати титром. Титром називають кількість грамів розчиненої речовини, що міститься в 1 мл розчину. Якщо в 1 л сульфатної кислоти з концентрацією 1н міститься 49,04 г Н2SO4, то титр цього розчину становитиме
ТН2SO4= 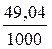 = 0,04904 г/мл.
= 0,04904 г/мл.
Розчинність речовин часто виражають масою речовини, що міститься в 100 масових частках розчинника. Наприклад, розчинність натрій хлориду за температури 18 °С дорівнює 35,86 г у 100 г води.
Якщо реакції відбуваються між розчинами речовин, їх склад зручно виражати через молярну концентрацію еквівалента. У цьому разі легко обчислити, в яких об’ємних відношеннях слід змішати розчини, щоб розчинені речовини прореагували без залишку.
Основна перевага цих (0,1н, 0,01н і т. д.) розчинів полягає в тому, що розчини однакової концентрації реагують між собою в однакових об’ємних співвідношеннях. Так, для нейтралізації 1 л 1н розчину хлоридної кислоти потрібно точно 1 л 1н розчину натрій гідроксиду, оскільки кожен із цих розчинів містить по одному еквіваленту речовини в 1 л.
Зрозуміло, що чим концентрованіший розчин ми маємо, тим у меншому об’ємі його міститиметься така сама кількість розчиненої речовини, як і в певному об’ємі більш розбавленого розчину. Отже, між об’ємом розчину і його молярною концентрацією еквівалента існує обернено пропорційна залежність:
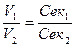 , або V1Cек1 = V2Cек2
, або V1Cек1 = V2Cек2
За цією залежністю можна не тільки обчислювати об’єми розчинів, потрібні для проведення реакцій, а й за об’ємами розчинів, що беруть участь у реакції, знаходити їхні концентрації.
 Запитання і завдання для контролю і самоконтролю знань
Запитання і завдання для контролю і самоконтролю знань
1. Що називається дисперсною системою і дисперсною фазою?
2. Що собою являють зависі, колоїди, істинні розчини?
3. Дайте визначення розчинності речовин. Від чого вона залежить?
4. Дайте визначення насиченим, ненасиченим і пересиченим розчинам.
5. Перелічіть способи вираження складу розчинів.
Лекція4.2. РОЗЧИНИ ЕЛЕКТРОЛІТІВ
План
Читайте також:
- I спосіб.
- IV. Запасні речовини
- Агрегатні стани речовини
- Адміністративно-правовий спосіб захисту прав
- Адміністративно-правовий спосіб захисту прав
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
- Азотисті речовини
- Алгебраїчний спосіб визначення точки беззбитковості
- Але відмінні від значення функції в точці або значення не існує, то точка називається точкою усувного розриву функції .
- Аморфний та кристалічний стан твердої речовини.
- Аналогія - спосіб отримання знань про предмети та явища на основі їхньої подібності з іншими.
- Атомарний рівень будови речовини
| <== попередня сторінка | | | наступна сторінка ==> |
| Розчини. Розчинність | | | Електролітична дисоціація |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |