
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція № 2. Насичені вуглеводні
План
1. Будова алканів.
2. Фізичні, хімічні властивості та застосування алканів.
1. Алкани, насичені вуглеводні – насичені ациклічні вуглеводні, що мають загальну формулу CnH2n+2, їх також називають парафінами. Більшість їх хімічних реакцій з різними реагентами починається з розриву зв'язку С-Н, тоді як їх розпад при високих температурах йде передусім по зв'язках С-С.
Гомологи – речовини, схожі по будові і хімічним властивостям та відрізняються один від одного по складу молекул на одну або декілька груп атомів СН2.
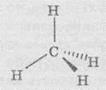 Кожен атом Карбону в алканах перебуває в стані sp3-гібридизації й утворює чотири σ-зв’язки С-С або С-Н , кути між якими дорівнюють 109,5°. Завдяки такій орієнтації зв’язки від одного атома Карбону в алканах спрямовані до вершин тетраедра. Довжина зв’язку С-С в алканах дорівнює 0,154 нм, енергія зв’язку – 354 кДж/моль. Атом Карбону утворює σ-зв’язок за рахунок перекривання гібридних орбіталей (sр3-, sр2- або sр-атомних орбіталей) з гібридними орбіталями іншого атома Карбону або будь-якими орбіталями атомів інших елементів. Перекривання здійснюється таким чином, що область максимальної електронної густини зосереджується в просторі між ядрами на прямій, що з’єднує центри атомів. Таке перекривання виявляється найбільш ефективним, а а -зв’язки, які при цьому виникають, — найбільш міцними.
Кожен атом Карбону в алканах перебуває в стані sp3-гібридизації й утворює чотири σ-зв’язки С-С або С-Н , кути між якими дорівнюють 109,5°. Завдяки такій орієнтації зв’язки від одного атома Карбону в алканах спрямовані до вершин тетраедра. Довжина зв’язку С-С в алканах дорівнює 0,154 нм, енергія зв’язку – 354 кДж/моль. Атом Карбону утворює σ-зв’язок за рахунок перекривання гібридних орбіталей (sр3-, sр2- або sр-атомних орбіталей) з гібридними орбіталями іншого атома Карбону або будь-якими орбіталями атомів інших елементів. Перекривання здійснюється таким чином, що область максимальної електронної густини зосереджується в просторі між ядрами на прямій, що з’єднує центри атомів. Таке перекривання виявляється найбільш ефективним, а а -зв’язки, які при цьому виникають, — найбільш міцними.
2. Перші чотири представники алканів від метану до бутану (C1-C4) – гази, від пентану до пентадекану (C5-C15) – рідини, від гексадекану (C16) – тверді речовини. Збільшення їх молекулярних мас призводить до збільшення температур кипіння і плавлення, при чому алкани з розгалуженим ланцюгом киплять при нижчій температурі, ніж алкани нормальної будови. Це пояснюється меншою вандерваальсівською взаємодією між молекулами розгалужених вуглеводнів у рідкому стані. Усі алкани являють собою безбарвні або білі речовини. Леткі вуглеводні мають характерний «бензиновий» запах. Вищі вуглеводні являють собою жирні на дотик м’які речовини, їхній типовий представник – парафін, з якого виготовляють свічі. Алкани практично не розчинні у воді, набагато легші за воду, неполярні і важко поляризуються, проте розчиняються в більшості неполярних розчинників, завдяки чому самі можуть бути розчинником для багатьох органічних сполук. Рідкі алкани легко змішуються один з одним. Багато фізичних властивостей (температура плавлення й кипіння) гомологів змінюються не лінійно, а «пилкоподібною» залежністю від кількості атомів Карбону.
Хімічні властивості алканів.За звичайних умов алкани хімічно інертні. Вони стійкі до дії багатьох реагентів: не взаємодіють із концентрованими сульфатною та нітратною кислотами, з концентрованими й розплавленими лугами, неокиснюються сильними окисниками — калій перманганатом KMnO4 тощо. Хімічна стійкість алканів пояснюється високою міцністю зв’язків C − C та C − H, а також їхньою неполярністю.
1.Галогенування. При взаємодії алканів з галогенами (хлором і бромом) під дією ультрафіолетового випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогензаміщених алканів.
Фторування. Взаємодія алканів з фтором відбувається з вибухом.
CH4 + F2 → CH3F + HF
При взаємодії алканів з більшим числом атомів Карбону можливий розрив C–C зв'язків. Для того щоб цьому запобігти фтор розводять рідким азотом
CH3–CH3 + 6F2 → CF3–CF3 + 6HF
Хлорування. Хлор реагує з алканами при нагріванні до 250–400 °С, під дією ультрафіолетового випромінювання або наявності каталізаторів ( пероксиди, йод, хлориди купруму, алюмінію).
Хлорування алканів при нагріванні, УФ-випромінюванні проходить за радикальним механізмом SR і складається з трьох основних стадій:
1) зародження ланцюга (ініціювання) Cl2 → Cl2• → 2Cl•
2) зростання ланцюга H3C–H + Cl• → HCl + •CH3
•CH3 + Cl–Cl → H3C•Cl + Cl•
3) обрив ланцюга (рекомбінація) Cl• + •CH3 → H3C–Cl
Cl• + •Cl → Cl2
H3C• + •CH3 → H3C–CH3
Бромування алканів відрізняється від хлорування вищою стереоселектівностью через більшу різницю в швидкостях бромування третинних, вторинних і первинних атомів Карбону при низьких температурах. При бромуванні пропану утворюється 3% 1-бромопропану і 97% 2-бромопропану, а при бромуванні 2-метилпропану утворюється 1% 1-бромо-2-метилпропану і 99% 2-бромо-2-метилпропану.
Йод є найменш активний галоген, тому процес йодування є найповільніший і потребує додаткової енергії. Тому на практиці застосовують спеціальні йодуючі агенти, наприклад трет-бутоксийодид (CH3)3C–OI.
Використовують також реакцію Х. Фенкельштайна (реакція обміну хлору з хлоралкану на йод під дією йодиду натрію NaI в ацетоновому розчині)
R–Cl + NaI → R–I + NaCl
2. Нітрування. Алкани реагують з 10% розчином нітратної кислоти або нітроген (ІV) оксидом NO2 в газовій фазі при температурі 1400C і невеликому тиску з утворенням нітропохідних RH + HNO3 → R–NO2 + H2O
Нітрування алканів проходить за радикальним механізмом.
У подібну реакцію жидкофазного нітрування вступають всі алкани, однак швидкість реакції і виходи нітросполук низькі. Найкращі результати спостерігаються з алканами, що містять третинні вуглецеві атоми.
3. Крекінг – процес термічного розкладання вуглеводнів, в основі якого лежать реакції розщеплення вуглецевого ланцюга великих молекул з утворенням сполук з більш коротким ланцюгом. Крекінг алканів є основою переробки нафти з метою отримання продуктів меншої молекулярної маси, які використовуються як моторне паливо, мастильні масла, а також сировини для хімічної і нафтохімічної промисловості. Для здійснення цього процесу використовуються два способи: термічний крекінг (при нагріванні без доступу повітря) і каталітичний крекінг (помірне нагрівання у присутності каталізатора). При температурі 450-7000С алкани розпадаються за рахунок розриву зв'язків С-С (міцніші зв'язки С-Н при такій температурі зберігаються) і утворюються алкани і алкени з меншим числом карбонових атомів
C4H10 → C2H6 + C2H4
Перетворення алканів при вищих температурах (700-10000С) називається піролізом. В даних умовах спостерігається глибший розклад алканів з утворенням ацетиленових вуглеводнів, сажі або коксу, водню тощо.
CH4 → C2H2 + H2 CH4 → C + H2
Каталітичний крекінг проводять у присутності каталізаторів (зазвичай оксидів алюмінію і кремнію) при температурі 4500С і атмосферному тиску. При цьому поряд з розривом молекул відбуваються реакції ізомеризації і дегідрування. Дегідрування алканів застосовується для одержання алкенів, алкінів та алкадієнів і відбувається при підвищених температурах з застосуванням каталізаторів (Pt, Ni, Cr2O3 тощо).
Дегідрування – реакція відщеплення водню.
CH3–CH3 → CH2=CH2 + H2
| <== попередня сторінка | | | наступна сторінка ==> |
| Мезомерний ефект (ефект спряження, резонансний ефект) | | | Окиснення алканів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |