
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції за участю гідроксильної групи.
1. Кислотні властивості. Зменшення електронної густини на атомі Оксигену веде до підвищення полярності зв’язку –О–Н, оскільки атом Оксигену сильніше, ніж у молекулі спирту, відтягує спільну пару електронів від атома Гідрогену. Атом Гідрогену набуває більшого часткового позитивного заряду 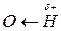 і легко може відщеплюватись у вигляді протону Н+, тому феноли виявляють сильніші кислотні властивості, ніж спирти. Феноли реагують не тільки з металами, але й з гідроксидами, утворюючі феноляти:
і легко може відщеплюватись у вигляді протону Н+, тому феноли виявляють сильніші кислотні властивості, ніж спирти. Феноли реагують не тільки з металами, але й з гідроксидами, утворюючі феноляти:
2С6Н5ОН + 2 Na → H2 + 2С6Н5ONa натрій фенолят
С6Н5ОН + NaОН → С6Н5ONa + H2О
У 1835 р. Ф. Рунге дав назву фенолу “карболова кислота” за його здатність взаємодіяти з лугом. Феноляти, на відміну від алкоголятів, не розкладаються водою. Водні розчини фенолятів мають лужну реакцію. Однак, при дії кислот, навіть такої слабкої як карбонатна відбувається їх розклад:
С6Н5ОNa + СО2 + H2О → С6Н5OН + NaНСО3.
2. Утворення етерів. Зручними методом синтезу фенілових етерів є взаємодія фенолятів лужних металів з галогенопохідними вуглеводнів:
С6Н5ОNa + СН3Br → С6Н5OСН3 + NaBr.
натрій фенолят метил бромід метилфеніловий етер
С6Н5ОNa + С6Н5Cl → С6Н5O С6Н5 + NaCl.
натрій фенолят хлоробензен дифеніловий етер
Дифеніловий етер одержують у присутності каталізатора – порошку міді.
Реакції по бензеновому ядру.У результаті зміщення електронної густини з гідроксильної групи на бензенове ядро, значно зростає реакційна здатність останнього.
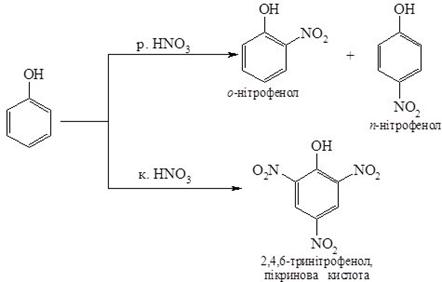
3. Нітруванняфенолу відбувається за кімнатної температури, при обробці розведеною нітратною кислотою з утворенням суміші орто- і пара-нітрофенолів. Використання концентрованої нітратної кислоти у цій реакції призводить до утворення 2,4,6-тринітрофенолу:
4. Бромування. Якщо бензен галогенується тільки за наявності каталізатора, то фенол бромується вже за кімнатної температури бромною водою. Відбувається заміщення атомів Гідрогену в о- і п- положеннях:
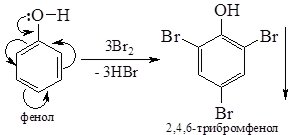
2,4,6-Трибромфенол не розчиняється у воді і випадає у вигляді білого осаду, що використовують для виявлення фенолу.
Фенол – одна із найстаріших дезінфікуючих речовин. Вперше у 1867 р. Дж. Лістер застосував його як бактерицидний засіб у хірургії. Фенол руйнує білкові речовини, через високу токсичність його застосовують лише зовнішньо. У техніці фенол використовують для добування різних фенольних смол, капролактаму, у синтезі лікарських засобів (аспірин). Пікринова кислота(гр. πγkροε – гіркий, гострий) (2,4,6-тринітрофенол) С6Н5ОН – жовті кристали, добре розчинні в органічних розчинниках, гірше – у воді, водні розчини жовтого кольору. У 1849 р. її почали використовувати як жовтий барвник для шовку. Це був перший випадок застосування синтетичного барвника. 2,4,6-Тринітрофенол – вибухонебезпечна речовина, в бурську війну (війна Британської імперії на півдні Африки проти місцевого населення) англійці використовували його під назвою “ліддіт”.
| <== попередня сторінка | | | наступна сторінка ==> |
| Способи добування | | | Лекція № 7. Альдегіди і кетони |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |