
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електронні структури ( конфігурації ) атомів
Умовний розподіл електронів по орбіталям на енергетичних рівнях і підрівнях називають електронною конфігурацією атома. Використовують 2 форми представлення. Розглянемо на прикладі атома сірки Z=16
а)1S²2S²2p⁶3S²3p⁴ 
[Ne]3S²3p⁴
б) 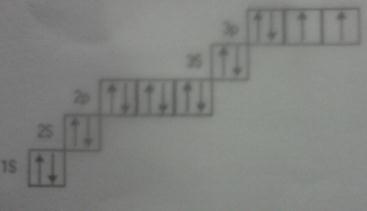
сумарний спін 0.5 + 0.5=1
У відповідності з правилом Хунда варіант б) дає інформацію про значення m1 електронів для окремих АО, число спарених і неспарених електронів.
[ ] - внутрішні або основні електрони - всі електрони, що містяться в атомі
інертного газу, який в пер. таблиці хімічних елементів стоїть перед даним елементом.
Якщо підрівні р-, d-, f- не повністю зайняті еквівалентними електронами, одній конфігурації відповідає декілька енергетичних стани, які називають атомними термами. Це результат взаємодії електронів. У відповідності з правилом Хунда для даної конфігурації з еквівалентними електронами основним станом буде стан з максимальним числом неспарених електронів на вироджених орбіталях (стан з максимальним сумарним спіном).
Нижчу енергію має терм з вищим значенням спіна. Мінімальній енергії атома відповідає максимальний сумарний спін (в одиницях h ).
В утворенні хімічних зв’язків найбільш активну участь приймають зовнішні (або валентні) електрони (підкреслені). Це ns-,np,(n-1) — електрони;
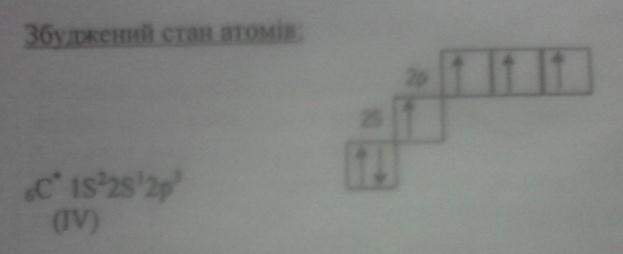
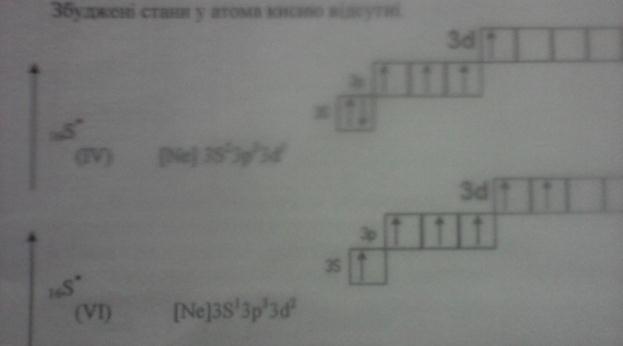
Атоми, знаходячись в основному стані, можуть поглинути квант енергії і перейти у збуджений стан з певною дискретною енергією, яка перевищує енергію основного стану на величину енергії поглинутого кванта.
Число неспарених електронів пояснює властивість насичення ковалентного зв’язку і визначає валентність атомів s-, р- елементів. Число неспарених електронів в такому атомі визначається правилом Хунда і наявністю вільних АО в тому ж квантовому шарі (рівні).
При збудженні атома електрони можуть переходити в ці вільні квантові енергетичні стани (квантові комірки), а атоми проявляти вищу валентність. Це можливо лише тоді, коли затрата енергії, необхідна для збудження атома і перехід електрона з однієї орбіталі на другу, невелика і компенсується енергією, що виділяється, при утворенні відповідної сполуки, в якій елемент проявляє вищу валентність.
Основний стан атомів:
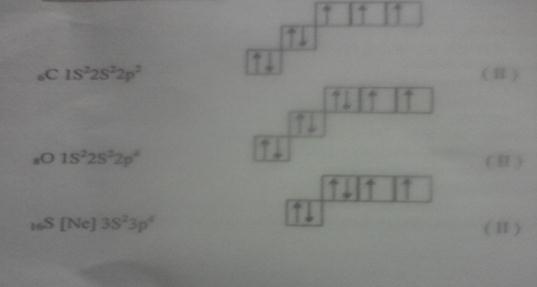
Збуджений стан атомів
Електронна структура атомів і періодична система елементів
Електронна теорія будови атомів пояснює періодичну зміну властивостей елементів. Збільшення позитивних зарядів атомних ядер від 1 до 110 спричинює періодичне повторення будови зовнішнього енергетичного рівня. А оскільки властивості елементів залежать в основному від числа Д. І. Менделєєва властивості хімічних елементів, а також форми і властивості їх сполук знаходяться в періодичній залежності від заряду ядер їх атомів.
Будова періодичної системи пояснюється електронною теорією будови атомів:
1. В одному періоді знаходяться елементи, атоми яких у незбудженому стані мають однакове число енергетичних рівнів.
2. Число елементів у кожному періоді визначається шах можливим сумарним числом електронів на енергетичних підрівнях даного періода.
3. В одній підгрупі містяться елементи, які мають подібну будову зовнішніх енергетичних рівнів і як наслідок аналогічні хімічні властивості.
Залежно від того, який рівень останнім заповнюється електронами, всі елементи поділяють на чотири типи s-, р-, d-, f- елементи.
4. s — елементи мають електронну конфігурацію [ ] ns1 або ns² [ ] (де [ ] - електронна конфігурація попереднього інертного елемента). Це елементи головних підгруп 1-ї та 2-ї груп періодичної системи елементів. У вільному стані вони є металами (виняток водень).
5. р - елементи мають електронні конфігурації зовнішнього енергетичного рівня ns2nрх, де 1≤ х ≤6. В них електронами заповняються р - орбіталі зовнішнього рівня. Це елементи головних підгруп третьої - восьмої груп. Виявляють проміжні властивості між металічними та не металічними або неметалічні властивості.
6. d-елементи мають електронну конфігурацію [ ] nS²(n-1)d˟,де 1 ≤x ≤10.В них електронами заповнюються d-орбіталі передостаннього енергетичного рівня.Максимальне число 5-ти d-орбіталей 10.Це перехідні елементи побічних підгруп IV- VI періодів (z=21 - 30; г = 39- 48; z = 57; 72 - 80) у VII періоді z = 89, 104 - 110). У вільному стані метали.
7. f -елементи - в атомах, яких заповнюються 4f-, або 5f - орбіталі. Максимальне число електронів на 7 f-орбіталях 14. У VI періоді - лантаноїди z = 58-71, у VII періоді - актиноїди z = 90 - 103). Перехідні f - елементи знаходяться у побічній підгрупі 3-ї групи, у вільному стані - метали.
8. Число електронів на зовнішньому енергетичному рівні атомів елементів головних підгруп (крім Не) = номеру групи періодичної системи.
Електронна теорія будови атомів пояснює також структуру періодичної системи - число груп, підгруп, періодів, положення елементів у групах і періодах.
У побічні підгрупи входять елементи , атоми яких мають на зовнішньому рівні по два або по одному електрону.
У елементів побічних підгруп валентними є електрони не тільки зовнішніх, а й передостанніх рівней.
Номер групи, як правило, вказує число електронів, які можуть брати участь в утворенні хімічного хв’язку.
Періодичність властивостей хімічних елементів.
Із збільшенням порядкового номера елемента спостерігається періодичність в зміні розмірів їх атомів (іонів), енергії іонізації, спорідненості до електрона, електронегативності, ступеню окислення ін.
Атоми не мають строгих границь, що обумовлено природою електронів. В розрахунках користуються ефективними радіусами (уявними).
У періоді атомний радіус у загальному випадку зменшується зліва на право (пояснюється ростом сили притягання електронів з ростом Ze). В підгрупах атомний радіус зростає зверху вниз (внаслідок зростання кількості електронних шарів).
Залежність властивостей елементів від будови його атома та положення в періодичній системі.
1 .Вплив будови зовнішнього енергетичного рівня на хімічні властивості елементів.
Енергетичні рівні та підрівні з максимально заповненими орбіталями є завершеними і найбільш стабільними.
Напівзаповнені р3 і d5 - підрівні - також стабільні.
Атоми металів, вступаючи в хімічні реакції, втрачають слабкозв’язані електрони зовнішніх енергетичних підрівнів.
Здатність елемента віддавати електрон є мірою його металічності, характеризують енергією іонізації (енергії, необхідної для відриву від атома найбільш слабко зв’язаного з ним електрона), Еі. Еі вимірюється в еВ/атом або в СІ кДж/моль. Еі атомів виявляє періодичну залежність від Z- порядкового номера елемента. Лужні метали - найменші значення.
Атоми неметалів у зовнішньому енергетичному рівні мають 4 і більше міцно зв’язаних з ядром електронів. Вступаючи в хімічну реакцію, як правило, приєднують електрони. Для порівняння неметалічних властивостей використовують спорідненість до електрона - це енергетичний ефект процесу, при приєднанні електрона до нейтрального атома. Ес вимірюється в еВ/атом, або в СІ кДж/моль .
Типові неметали Б, СІ, Вг, І - мають найбільше значення Ес.
Еі для елементів одного періода зростає зліва на право із збільшенням Ze. В підгрупі Еі зменшується зверху вниз внаслідок збільшення відстані електрона до ядра.
Електронегативність - здатність атома даного елемента до відтягування на себе в сполуках електронної густини в порівнянні з другими елементами, (валентних електронів, які беруть участь в утворенні хімічного зв’язку).
(Вперше поняття і шкалу ввів американський вчений Л. Полінг в 1932 р.).
X= Еі+ Ес ; 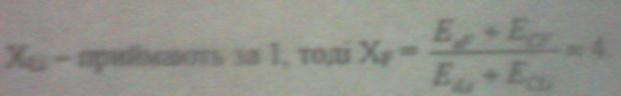
Відносна електронегативність в періоді зростає із збільшенням Z ;в групі - зменшується. Її значення служить мірою неметалічності елементів.
І.Зміни в межах одного періоду. Властивості атомів елементів 3-го періоду
| Хімічний елемент | Група | Заряд ядра Ze | Електронна конфігурація [Ne] … | Атомний радіус, нм | Еі, еВ/атом | Ec, еВ/атом |
| Na | I | +11 | 3S1 | 0.17 | 5.14 | 0.3 |
| Mg | II | +12 | 3S2 | 0.13 | 7.64 | -0.2 |
| Al | III | +13 | 3sV | 0.13 | 5.98 | 0.2 |
| Si | IV | +14 | 3S23p2 | 0.11 | 8.15 | 1.8 |
| P | V | +15 | 3S23p3 | 0.09 | 10.49 | 0.8 |
| S | VI | +16 | 3Sz3p4 | 0.08 | 10.36 | 2.1 |
| CI | VII | +17 | 3S23p5 | 0.07 | 13.01 | 3.6 |
| Ar | VIII | +18 | 3S23p6 | 0.07 | 15.75 | -0.4 |
| У великих періодах зі збільшенням Z металічні властивості послаблюються, а неметалічні посилюються повільніше, ніж у малих. 3.Зміни в межах однієї групи (на прикладі І А групи.) Елементи однієї підгрупи мають однакову будову зовнішнього енергетичного рівня та подібні хімічні властивості. |
| Хімічний елемент | Z | Ar | Електрон на конфігура ція | tпл, °С | p,кг\м³ | Atomh ий радіус, нм | Еі, еВ/атом | Електро негатив ність |
| Li | 6.94 | [He]2S‘ | 180.5 | 0.155 | 5.39 | 1.0 | ||
| Na | 29.991 | [Ne]3S | 97.8 | 0.189 | 5.14 | 0.9 | ||
| K | 39.100 | [Ar]4S' | 63.7 | 0.236 | 4.34 | 0.8 | ||
| Rb | 85.48 | [KT15S1 | 38.9 | 0.248 | 4.18 | 0.8 | ||
| Cs | 132.91 | [Xe]6S' | 28.7 | 0.262 | 3.89 | 0.7 | ||
| Fr | [Rn]7S‘ | 8.0 | 0.37 | 3.83 | 0.8 |
Внутрішня та вторинна періодичність
Поглиблення уявлень про аналогію між елементами показало, що крім основної періодичності, яка зумовлена періодичним повторенням електронних конфігурацій атомів, існують також внутрішня і вторинна періодичності.
Внутрішня періодичність полягає в тому, що властивості елементів та їхніх сполук у горизонтальних рядах (в залежності від Z) змінюються не монотонно. Виявляється у зміні Еі в малих і, особливо, великих періодах періодичної системи.
Вторинна періодичність. Зміна властивостей (Еі rат ) у підгрупах елементів має періодичний немонотонний характер (внутрішні шах, min). Це явище згідно квантової механіки пояснюється ефектом проникнення зовнішніх електронів через шари внутрішніх до ядра (т.б. існує значна ймовірность їх знаходження поблизу ядра в області внутрішніх К-та L - електронних шарів.)
Вказаний ефект збільшує міцність зв’язку зовнішніх елементів з ядром.
Так, наприклад, внаслідок більш глибокого проникнення S-електрони в більшій степені екранують заряд ядра, ніж р - електрони, а останні - сильніше, ніж d - електрони і т. д.


 Схематично зміну властивостей елементів у періодах і групах можна зобразити
Схематично зміну властивостей елементів у періодах і групах можна зобразити
Період
|
 | |||
 | |||
|
| <== попередня сторінка | | | наступна сторінка ==> |
| Послідовність заповнення електронами енергетичних рівнів, підрівнів у багатоелектронних атомах | | | Професіограма сімейного лікаря |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |