
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Приклади розв’язку типових задач
Приклад 1. Необоротна хімічна реакція відбувається за першим порядком. За 15 хвилин прореагувало 67% вихідної речовини. Чому дорівнює константа швидкості реакції і час напіврозпаду?
Розв’язок. Для реакції першого порядку константа швидкості може бути розрахована за формулою:
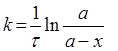 ,
,
де а – початкова кількість вихідної речовини, х – кількість речовини, що прореагувала на момент часу τ. х = 0.67 а. Тоді:
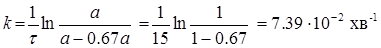
Час напіврозпаду для реакції першого порядку дорівнює:
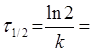
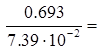 9.38 хв.
9.38 хв.
Приклад 2. Для бімолекулярної реакції О·(г) + ОН·(г) →О2(г) + Н·(г)константа швидкості дорівнює k = 1.3·1010 л·моль-1·с-1. Порівняйте швидкості даної реакції а)за еквімолярного співвідношення вихідних реагентів на початку реакції ([О·]0 = [ОН·]0 = 1.0·10-4 моль·л-1 ) і б) за нееквімолярного співвідношення їх початкових концентрацій ( [О·]0 = 1.0·10-4 моль·л-1, [ОН·]0 = 2.0·10-4 моль·л-1). Чому буде дорівнювати концентрація О·(г) через 1.0·10-6 секунди у ціх двох випадках?
Розв’язок. Швидкість реакції за законом дії мас для елементарної стадії реакції дорівнює:
а) 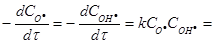 1.3·1010·1.0·10-4 1.0·10-4 = 130 моль·л-1 с-1;
1.3·1010·1.0·10-4 1.0·10-4 = 130 моль·л-1 с-1;
б) 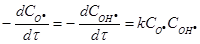 = 1.3·1010·1.0·10-4 2.0·10-4 = 260 моль·л-1 с-1;
= 1.3·1010·1.0·10-4 2.0·10-4 = 260 моль·л-1 с-1;
Розрахунки показують, що збільшення концентрації одного з реагентів вдвічі, прискорює і швидкість реакції вдвічі.
Кінетичні рівняння для реакції другого порядку за еквімолярного (а) і нееквімолярного (б) співвідношеннях реагентів розрізняються. Для еквімолярного співвідношення між концентраціями О·(г) і ОН·(г) скористаємось рівнянням:
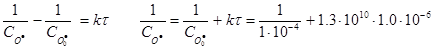 = 2.3·104 л·моль-1.
= 2.3·104 л·моль-1.
Звідки 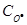 = 4.35·10-5 моль л-1.
= 4.35·10-5 моль л-1.
Для випадку нееквімолярного співвідношення вихідних реагентів (варіант б) кінетичне рівняння набуває вигляду:
 ;
;
де х – кількість вихідної речовини, що прореагувала на момент часу τ. Після підстановки вихідних даних одержуємо:
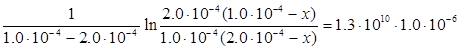
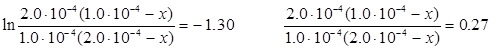
Звідки х = 8.44·10-5 моль л-1 і концентрація О·(г) на момент часу 1.0·10-6 с дорівнює: 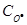 =
= 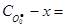 1.0·10-4 - 8.4·10-5 = 1.6·10-5 моль л-1.
1.0·10-4 - 8.4·10-5 = 1.6·10-5 моль л-1.
Приклад 3. При дослідженні термічного розкладу AsH3 (Т = 3500С) за рівнянням 2AsH3(г) = 2 As(тв) + 3Н2 вимірювали зміну загального тиску газової фази з часом:
| τ, год. | 3.84 | 17.1 | 25.00 | 39.91 | 45.02 | |
| Заг.тиск(РΣ), см Hg | 39.2 | 40.3 | 43.65 | 45.35 | 48.05 | 48.85 |
Визначіть порядок реакції і розрахуйте константу швидкості реакції.
Розв’язок. Тиск на початку реакції становить Р0 (Р0 =39.2 см Hg). В ході реакції парціальний тиск AsH3 зменшиться і буде становити на момент часу τ: 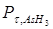 = Р0–2х. Парціальний тиск водню на цей момент буде дорівнювати 3х, а загальний тиск в системі дорівнює сумі парціальних тисків компонентів, що знаходяться у газовій фазі: РΣ = Р0–2х + 3х = Р0 + х. Значення х на момент часу τ буде дорівнювати: х = РΣ - Р0.
= Р0–2х. Парціальний тиск водню на цей момент буде дорівнювати 3х, а загальний тиск в системі дорівнює сумі парціальних тисків компонентів, що знаходяться у газовій фазі: РΣ = Р0–2х + 3х = Р0 + х. Значення х на момент часу τ буде дорівнювати: х = РΣ - Р0.
| τ, год. | 3.84 | 17.1 | 25.00 | 39.91 | 45.02 |
| х, см Hg | 1.1 | 4,45 | 6,15 | 8,85 | 9,65 |
Для визначення порядку реакції скористаємось методом підстановки. Для цього в кінетичні рівняння реакцій різних порядків підставимо значення тисків і відповідного часу. Рівняння, розрахунок за яким дасть стабільні значення константи швидкості, вкаже на порядок реакції. Для необоротної реакції першого порядку кінетичне рівняння має вигляд:
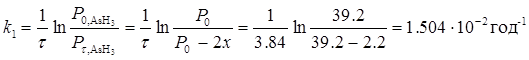
Аналогічні розрахунки для інших моментів часу і відповідних величин "х" дають наступні значення констант швидкостей: τ = 17.1год. х = 4.45 см, k2=1.506·10-2год-1; τ = 25.00 год. х =6.15 см, k3=1.506·10-2 год-1; τ = 39.91год. х =8.85 см, k4=1.505·10-2год-1; τ = 45.02год. х = 9.65 см, k2=1.506·10-2год-1.
Константа практично не змінюється. Розрахунок проводився за рівнянням необоротної реакції першого порядку. Таким чином дана реакція є реакцією першого порядку. Середнє значення константи швидкості kсер=1.506·10-2год-1.
Приклад 4. Розрахуйте порядок реакції хлорування пропанолу, якщо відомі наступні кінетичні дані:
| τ, хв. | ||
| С1(пропанол), моль/л | 0.00924 | 0.0050 |
| С2(пропанол), моль/л | 0.00481 | 0.00259 |
Розв’язок. Для розв'язку скористаємось методом Вант-Гоффа:
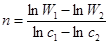 .
.
Середні швидкості реакції дорівнюють w = Δc/Δτ :
W1 = (0.00924 - 0.00500)/ 3= 1.413·10-3моль·л-1·с-1,
W2 = (0.00481 - 0.00259)/ 3 = 7.400·10-4моль·л-1·с-1,
Середні швидкості відповідають середнім значенням концентрацій:
С1(сер) = (0.00924 + 0.00500)/ 2 = 0.00712 моль·л-1
С2(сер) = (0.00481 + 0.00259)/ 2 = 0.0037 моль·л-1
Порядок реакції становить:
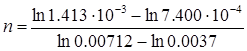 = 0.991≈ 1.
= 0.991≈ 1.
Дана реакція проходить за першим порядком.
Приклад 5. Швидкість реакції (С2Н5)3N + CH3I → [(С2Н5)3N+( CH3)]I- у нітробензолі визначалась за температури 250С і були одержані значення:
| τ, с | ||||||
| х, моль·л-1 | 0,00876 | 0,01066 | 0,01208 | 0,01392 | 0,01476 | 0,01538 |
де τ – час; х – кількість триетиламіну чи йодистого метилу, що прореагували на момент часу τ. Початкові концентрації вихідних реагентів однакові і дорівнюють С0 = 0.0198 моль л-1. Реакція проходить за другим порядком. Розрахуйте константу швидкості реакції.
Розв’язок. Дана реакція відноситься до реакцій другого порядку з еквімолярним співвідношенням реагентів. Для таких реакцій константу швидкості розраховуємо за рівнянням:
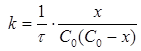
де х – кількість вихідної речовини, що вступила в реакцію на момент часу τ.
Розрахунок константи швидкості на момент часу τ = 1200 с одержуємо:
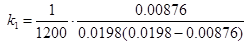 = 0.0334 л·моль-1·с-1;
= 0.0334 л·моль-1·с-1;
На момент часу τ = 1800 с константа становить:
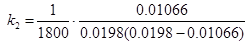 = 0.0327 л·моль-1·с-1;
= 0.0327 л·моль-1·с-1;
Аналогічні розрахунки для інших проміжків часу дають значення констант:
k = 0.0329; 0.0332; 0.0329; 0.0325 л·моль-1·с-1.
Середнє значення константи швидкості дорівнює 0.0329 л·моль-1·с-1.
Приклад 6.Константа швидкості хімічної реакції нульового порядку А→В становить k = 5·10-8 моль л-1·c-1. За який час концентрація вихідної речовини зміниться: а) від 4·10-4 моль л-1 до 2·10-4 моль л-1: б) від 2·10-4 моль л-1 до 1·10-4 моль л-1 ?
Розв’язок. В обох випадках концентрація вихідного реагенту зменшується вдвічі, тому цей час дорівнює напівперіоду реакції τ1/2. Для реакції нульового порядку напівперіод реакції можна розрахувати за формулою:
τ1/2 = 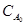 /(2k)
/(2k)
де 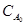 - початкова концентрація вихідної речовини.
- початкова концентрація вихідної речовини.
Для варіанту "а" напівперіод реакції становить:
τ1/2 = 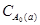 /(2k) =
/(2k) = 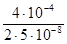 = 4·103 с.
= 4·103 с.
Для варіанту "б" τ1/2 = 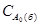 /(2k) =
/(2k) = 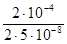 = 2·103 с.
= 2·103 с.
З аналізу рівнянням τ1/2 = f( 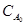 ) та одержаних результатів можна зробити висновок, що початкова концентрація речовини впливає на величину напівперіоду реакції нульового порядку і при зростанні початкової концентрації цей час збільшується прямопропорційно.
) та одержаних результатів можна зробити висновок, що початкова концентрація речовини впливає на величину напівперіоду реакції нульового порядку і при зростанні початкової концентрації цей час збільшується прямопропорційно.
Приклад 7. Послідовна реакція першого порядку проходить за схемою:
|
А → В → С
За температури 298 К константи швидкостей дорівнюють: k1 = 0.05 хв-1, k2 = 0.1 хв-1. Початкова концентрація вихідної речовини "А" дорівнює СА(0) =1 моль/л. Розрахуйте: 1) час досягнення максимальної концентрації проміжної речовини "В"; 2) максимальну концентрацію речовини "В" в ході реакції; 3) концентрації речовин "А" і "С" на момент часу τмакс.
Розв’язок. 1) Час досягнення максимальної концентрації проміжної речовини розраховуємо за формулою:
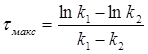 =
= 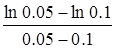 = 13.86 хв.
= 13.86 хв.
2) Максимальна концентрація речовини "В" відповідає часу τмакс і дорівнює:
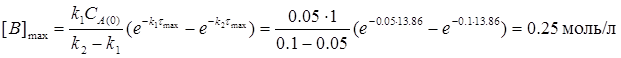 3) Концентрації речовин "А" і "С" на цей момент часу дорівнюють:
3) Концентрації речовин "А" і "С" на цей момент часу дорівнюють:
СА = СА(0) 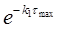 = 1·
= 1· 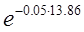 = 0.5 моль/л
= 0.5 моль/л
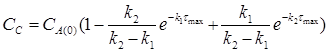 =
=
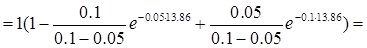 0.25 моль/л
0.25 моль/л
Приклад 8. Для реакції піролізу метану був запропонований наступний механізм:
 СН4
СН4  k1
k1 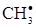 +
+ 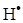
 СН4 +
СН4 + 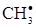
 k2 С2Н6 +
k2 С2Н6 + 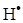
 СН4 +
СН4 + 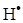 k3
k3 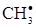 + H2
+ H2

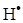 +
+ 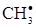 + M k4 СН4 + M
+ M k4 СН4 + M
М – частинка, що відводить енергію рекомбінації 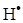 і
і 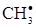 . Вивести рівняння для швидкості утворення етану, приймаючи концентрації
. Вивести рівняння для швидкості утворення етану, приймаючи концентрації 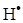 і
і 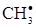 дуже малими і стаціонарними.
дуже малими і стаціонарними.
Розв’язок. Етилен утворюється на другий стадії і швидкість його утворення за законом дії мас дорівнює:
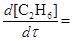 k2 [СН4][
k2 [СН4][ 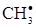 ]; (a)
]; (a)
В одержаному рівнянні присутня активна частинка 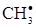 , концентрацію якої необхідно виразити через концентрації стабільних частинок. Для цього записуємо швидкість утворення
, концентрацію якої необхідно виразити через концентрації стабільних частинок. Для цього записуємо швидкість утворення 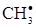 в ході даної реакції і прирівнюємо її до нуля:
в ході даної реакції і прирівнюємо її до нуля:
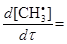 k1[СН4]–k2[СН4][
k1[СН4]–k2[СН4][ 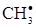 ]+k3[
]+k3[ 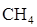 ][
][ 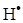 ]-k4[
]-k4[ 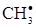 ][
][ 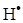 ][M]=0 (b)
][M]=0 (b)
В одержаному рівнянні необхідно виразити концентрацію активної частинки 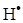 через концентрації стабільних реагентів. Аналогічно попередньому запишемо швидкість її утворення і прирівняємо до нуля:
через концентрації стабільних реагентів. Аналогічно попередньому запишемо швидкість її утворення і прирівняємо до нуля:
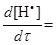 k1[СН4] + k2[СН4][
k1[СН4] + k2[СН4][ 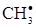 ] – k3[СН4][
] – k3[СН4][ 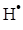 ] – k4[С
] – k4[С 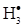 ][
][ 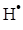 ][M]=0 (с)
][M]=0 (с)
Додамо рівняння " b " до рівняння "с" і одержимо:
k1[СН4] – k4[С 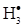 ][
][ 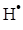 ][M]= 0
][M]= 0
[С 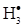 ][
][ 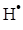 ]=
]= 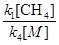 (d)
(d)
Віднімемо від рівняння " b " рівняння "с":
-k2[СН4][ 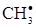 ] + k3[СН4][
] + k3[СН4][ 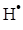 ] =0
] =0
звідки [ 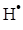 ] = [
] = [ 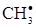 ]
] 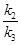 (е)
(е)
Підставимо значення [ 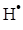 ] з рівняння (е) в рівняння (d):
] з рівняння (е) в рівняння (d):
[ 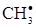 ]2 =
]2 = 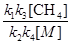 чи [
чи [ 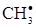 ] =
] = 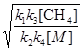 (f)
(f)
Після підстановки значення [ 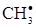 ] з рівняння (f) в рівняння (a) одержуємо вираз для швидкості утворення етану:
] з рівняння (f) в рівняння (a) одержуємо вираз для швидкості утворення етану:
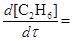 k2 [СН4]
k2 [СН4] 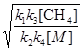 =
= 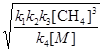
Приклад 9. Реакція розкладу трихлороцтової кислоти є реакцією першого порядку. За температури 250С константа швидкості реакції дорівнює k1 = 1.7·10-7 с-1, а за температури 450С k2 = 1.33·10-5 с-1. Розрахуйте енергію активації, температурний коефіцієнт Вант-Гоффа реакції і передекспонентний множник константи швидкості в рівнянні Арреніуса.
Розв’язок. Для розв'язку задачі скористуємось рівнянням Арреніуса:
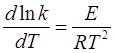
Розділімо змінні і проінтегруємо визначеним інтегралом (E= const):
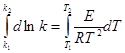
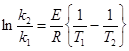
звідки: 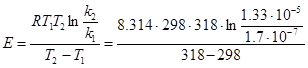 = 171740 Дж/моль.
= 171740 Дж/моль.
Визначення температурного коефіцієнту реакції проводимо за рівнянням:
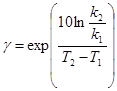 =
=  = 2.18
= 2.18
Для розрахунку передекспонентний множника скористаємось інтегральною формою рівняння Арреніуса:
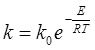 , звідки
, звідки 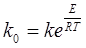
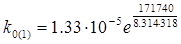 = 2.16·1023 с-1
= 2.16·1023 с-1
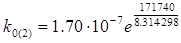 = 2.16·1023 с-1
= 2.16·1023 с-1
Середнє значення передекспонентний множника:
k0 = 2.16·1023 с-1
Приклад 10. Бімолекулярна реакція 2НІ = Н2 + І2 має енергію активації Е=185000 Дж/моль. Реакція відбувається за температури Т = 570 К. Діаметр молекули НІ становить σ1,2 = 3.5·10-8 см. Концентрація НІ дорівнює 1 моль/л. Розрахуйте константу швидкості реакції за температури 570 К, якщо стеричний фактор дорівнює р=1.
Розв’язок. Для визначення константи швидкості скористаємось рівнянням теорії активних зіткнень для розрахунку константи швидкості реакції, в якій відбуваються зіткнення між однаковими частинками:
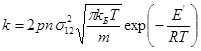
Число частинок в 1 м3 становить: n = 1(моль/л)·NA·1000 = 6.023·1026.
Середній ефективний діаметр зіткнення молекул НІ дорівнює:
σ12 = 3.5·10-8 см =3.5·10-10 м
Масу одної молекули НІ в кг визначаємо за формулою:
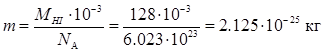
Істинна енергія активації (Е') відрізняється від ефективної енергії активації (Е) на величину середньої енергії теплового руху молекул:
Е' = Е - 0.5RT= 185000 - 0.5·8.314·570 =182630 Дж/моль
Після підстановки розрахованих величин, констант і температури в рівняння константи швидкості, одержимо:
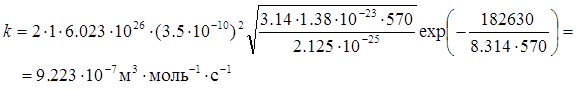
Приклад 11. Для реакції Н·(г) + Н2(г)↔ (Н−Н−Н)→ Н2(г) + Н·(г) за температури 298К енергія активації дорівнює Е=23000 Дж/моль, передекспонентний множник в рівнянні Арреніуса k0=1.5·1010 л/(моль·с). Розрахуйте зміну ентальпії ( 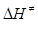 ) і ентропії (
) і ентропії ( 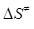 ) при утворенні активного комплексу (Н−Н−Н). Трансмісійний множник дорівнює χ = 1.
) при утворенні активного комплексу (Н−Н−Н). Трансмісійний множник дорівнює χ = 1.
Розв’язок. Величину зміни ентальпії за температури Т при утворенні активного комплексу можна визначити за відомим значенням енергії активації (Е) (х – число молекул у вихідному стані):
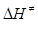 = Е – хRT = 23000 – 2·8.314·298 = 18045 Дж/моль.
= Е – хRT = 23000 – 2·8.314·298 = 18045 Дж/моль.
Для визначення зміни ентропії утворення активного комплексу скористаємось рівнянням:
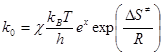 ,
,
звідки: 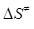 = R
= R 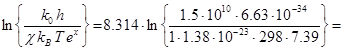 -66.7 Дж/(моль·К)
-66.7 Дж/(моль·К)
Приклад 12. Визначено, що для розпізнання об'єкта, в людське око повинно попасти мінімальна кількість світлової енергії, рівна 1·10 -17 Дж. Яка кількість фотонів світла жовтого кольору (λ = 590 nm) необхідна для перенесення такої кількості енергії?
Розв’язок. Енергія одного фотону з такою довжиною хвилі дорівнює:
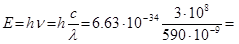 3.37·10-19 Дж
3.37·10-19 Дж
Звідки число необхідних фотонів дорівнює:
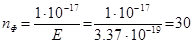 фотонів.
фотонів.
Приклад 13. Чому дорівнює довжина хвилі світла, що поглинається зв'язком С=О в молекулі ацетону, якщо енергія зв’язку дорівнює 728 кДж/моль? Чи можливо розірвати цей зв'язок енергією світла ртутної лампи, якщо довжина світла, що випромінюється лампою дорівнює 254 nm?
Розв’язок. Згідно закону Ейнштейна-Штарка на кожну активовану молекулу (зв'язок) припадає один квант радіації. Енергія, що необхідна для розриву 6.023·1023 (1 моль) зв'язків, дорівнює:
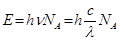 , звідки:
, звідки: 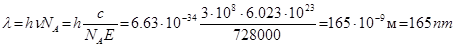
Розрахунок показує, що довжина світла не є ефективною для розриву цього зв’язку.
2.3 Задачі для самостійної роботи
| <== попередня сторінка | | | наступна сторінка ==> |
| Основні рівняння і символи | | | Задача 2.1 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |