
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Константи рівноваги окисно-відновних реакцій
Напрям протiкання окисно-вiдновних реакцiй можна встановити за величинами стандартних окисно-вiдновних потенцiалів пар. Однак, для розрахунку повноти протiкання реакцiї потрiбно користуватися значеннями констант рiвноваги. Для будь-якої окисно-вiдновної реакцiї
aОк1 + bВiдн2 « aВiдн1 + bОк2 (X)
стан рiвноваги описується виразом
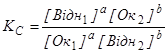 , (6.8)
, (6.8)
де KC – концентраційна константа рівноваги.
Якщо представити цю реакцiю у виглядi двох пiвреакцiй та визначити їх потенцiали j
a ½ Ок1 + be– « Вiдн1 j1 = jo1 + (0.059/b)lg[Ок1]/[Відн1] (6.9)
–b ½ Ок2 + ae– « Вiдн2 j2 = jo2 + (0.059/a)lg[Ок2]/[Відн2] (6.10)
___________________________
aОк1 + bВiдн2 « aВiдн1 + bОк2,
то в стані рiвноваги, j1 = j2. Звiдcи
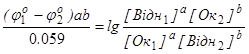 . (6.11)
. (6.11)
Вираз пiд логарифмом є константою рiвноваги
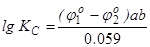 , (6.12)
, (6.12)
де ab=n – спiльне число електронiв, що передаються при протіканні окисно-відновної реакцiї.
Якщо КС > 1´103, то реакцiя протiкає майже до кiнця злiва направо (практично незворотня), однак, якщо КС < 1´103, то реакцiя злiва направо практично не протiкає. При промiжних значеннях KС реакцiя до кiнця не протiкає, тобто при рiвновазi в розчинi присутнi в помiтнiй кiлькостi як вихiднi речовини, так i продукти реакцiї.
Переглядів: 1740