
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Криві окисно-відновного титрування
В кожен момент титрування пiсля доливання деякої порцiї титранту швидко встановлюється рiвновага i концентрацiї вихiдних речовин та продуктiв реакцiї стають рiвноважними. Їх можна обчислити, виходячи з початкових концентрацiй вихiдних реагентiв та константи рiвноваги.
Кривi титрування для окисно-вiдновних реакцiй можуть бути побудованi в координатах потенцiал – об'єм титранта. Потенціал системи можна обчислювати за величиною окисно-вiдновного потенцiалу будь-якої редокс-пари (визначуваної речовини або титранта). Але до точки еквiвалентностi розрахунок величини потенцiалу зручнiше вести за напiвреакцiєю з участю визначуваної речовини, а пiсля точки еквiвалентностi – за напiвреакцiєю з участю титранту.
Розглянемо побудову кривої титрування на прикладi визначення Fe2+ в кислому середовищi бiхроматометричним методом. Нехай маємо 100 мл 0,1 М розчину FeSO4, який будемо титрувати розчином бiхромату калiю з концентрацiєю C(1/6K2Cr2O7) = 0,1 М. З вiдповiдних пiвреакцiй
Fe2+ – e– « Fe3+ ½6
Cr2O72– + 14H+ + 6e– « 2Cr3+ + 7H2O ½1
________________________________________
6Fe2+ + Cr2O72– + 14H+ « 6Fe3+ + 2Cr3+ + 7H2O. (XIV)
та стандартних потенцiалів редокс-пар
jo(Cr2O72–/2Cr3+) = 1.33 > 0.77 = jo(Fe3+/Fe2+)
можна стверджувати, що пара Cr2O72–/2Cr3+ є окисником по вiдношенню до пари Fe3+/Fe2+.
Обчислимо константу рiвноваги для цiєї реакцiї:
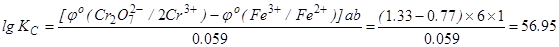 ,
,
KC = 1056.95 = 8.895´1056.
Так як KC = 8.895´1056 >> 103, то рiвновага реакцiї зсунута вправо. Це означає, що кiлькiсть моль-еквівалентів утвореного Fe3+ на дiлянцi до точки еквiвалентностi буде практично рiвна кiлькостi моль-еквiвалентiв доданого K2Cr2O7.
На дiлянцi до точки еквiвалентностi величину потенцiалу можна обчислити за рiвнянням Нернста для редокс-пари Fe3+/Fe2+:
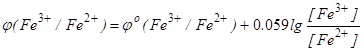 . (6.16)
. (6.16)
При доливаннi 50 мл розчину K2Cr2O7 розчин Fe2+ буде вiдтитрований на 50 %, тобто концентрацiя Fe3+ стане пропорцiйною об'єму долитого титранту, а концентрацiя Fe2+ пропорцiйною об'єму невiдтитрованого розчину двохвалентного феруму:
j (Fe3+/Fe2+) = 0.77 + 0.059lg(50/50) = 0.77 B.
Аналогiчно обчислюємо потенцiал системи для iнших об'ємiв долитого титранту:
90 мл титранту: j (Fe3+/Fe2+) = 0.77 + 0.059lg (90/10) = 0.821 B;
99 мл титранту: j (Fe3+/Fe2+) = 0.77 + 0.059lg (99/1) = 0.888 B;
99.9 мл титранту: j (Fe3+/Fe2+) = 0.77 + 0.059lg (99.9/0.1)= 0.947 B.
В точцi еквiвалентностi концентрацiї Fe2+, як i Cr2O72–, будуть дуже малими i їх можна розрахувати користуючись константою рiвноваги:
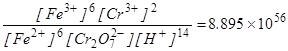 . (6.17)
. (6.17)
Позначимо рiвноважну концентрацiю Cr2O72– в точцi еквiвалентностi [Cr2O72–]=x, тодi [Fe2+]=6x i концентрацiї iнших учасникiв реакцiї складуть: [Fe3+]=0.1–6x; [Cr3+]=0.2–2x; [H+]=1 моль/л Пiдставляючи наведенi величини концентрацiй в рiвняння (6.17), одержимо:
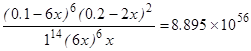 , (6.18)
, (6.18)
Звідки можна обчислити x. Знайдемо спочатку наближене значення x за умови, що [Fe3+]»0.1 та [Cr3+]»0.2 моль/л: x = 1.382´10–10.
У точцi еквiвалентностi:
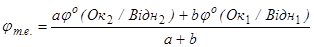 (6.19)
(6.19)
jт.е. = (0.77 + 6´1.33 – 0.022)/7 = 1.247 В, (6.20)
Пiсля точки еквiвалентностi в розчинi зростає надлишок K2Cr2O7 при практично незмiннiй концентрацiї Cr3+, тому величину потенцiалу системи зручно обчислювати за формулою:
j (Cr2O72–/2Cr3+) = jo (Cr2O72–/2Cr3+) + (0.059/6)lg([Cr2O72–]/[Cr3+]2). (6.21)
Для надлишку титранта в 0.1 мл концентрацiя Cr2O72– буде складати
[Cr2O72–] = (0.1´0.1)/100 = 0.0001 M; [Cr3+] = 0.2 M.
Вiдповiдно, для 100.1 мл титранту
j (Cr2O72–/2Cr3+)=1.33 +(0.059/6)lg(0.0001/0.22) = 1.304 B
Аналогiчно для всiх iнших надлишкiв титранта:
101 мл титранту [Cr2O72–] = 0.1´1/100 = 0.001 M; j (Cr2O72–/2Cr3+) = 1.314 B;
110 мл титранту [Cr2O72–] = 0.1´10/100 = 0.01 M; j(Cr2O72–/2Cr3+) = 1.324 B;
150 мл титранту [Cr2O72–] = 0.1´50/100 = 0.05 M; j (Cr2O72–/2Cr3+) = 1.331 B.
Таблиця 6.1
Розрахунок потенціалів при титрування розчину ферумуконцентрацією С(FeSO4) =0,1 М розчином титранту концентрацією С(1/6 K2Cr2O7)=0,1 М
| V(K2Cr2O7), см3 | Надлишок, см3 | Обчислення | Е, В | |
| FeSO4 | K2Cr2O7 | |||
| - | 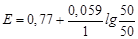
| 0,77 | ||
| - | 
| 0,821 | ||
| - | 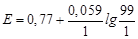
| 0,888 | ||
| 99,9 | 99,9 | - | 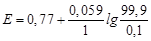
| 0,947 |
| 100 (т.е.) | - | - | 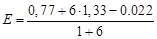
| 1,247 |
| 100,1 | - | 0,1 | 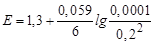
| 1,304 |
| - | 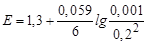
| 1,314 | ||
| - | 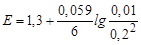
| 1,324 | ||
| - | 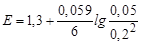
| 1,331 |
За розрахованими даними будуємо криву титрування (рис. 6.3) в координатах j вiд V титранту, яка за формою нагадує криву титрування кислоти основою.
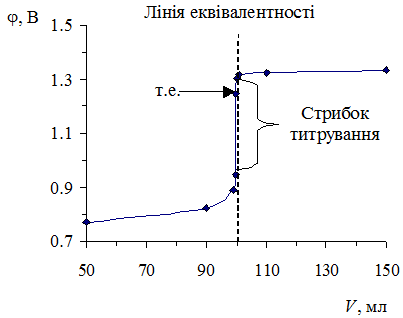
Рис. 6.3.Крива титрування розчину FeSO4 розчином K2Cr2O7.
На графiку можна зобразити лiнiю еквiвалентностi та видiлити рiзке зростання потенцiалу біля точки еквiвалентностi вiд 99.9 до 100.1 мл титранту (стрибок потенціалу):
Δj = 1.304 – 0.947 = 0.357 B.
Величина стрибка залежить вiд природи реагуючих речовин. На величину стрибка титрування можуть впливати кислотність розчину, протікання побічних реакцiй комплексоутворення, осадження, гідролiзу. Знаючи межi стрибка титрування, можна вибрати вiдповiдний iндикатор, iнтервал переходу якого повинен лежати в межах стрибка титрування.
Переглядів: 1101