
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ЛЕКЦІЯ № 1. Загальні відомості про корозію металів
Корозія – руйнування металів унаслідок хімічної або електрохімічної взаємодії їх з корозійним середовищем.
Під корозією промислових і будівельних матеріалів, розуміється їх руйнування (від лат. соггоsio — роз'їдання) під впливом природних і виробничих дій. В процесі корозії порушується рівновага між умовами, в яких матеріали сформувалися, і умовами, в яких вони експлуатуються.
З природних дій руйнування матеріалів викликають атмосферні опади, зміни температури і вогкості, поперемінне заморожування і відтавання, природні води, циркулюючі у верхніх горизонтах земної кори, гази, що містяться в атмосфері і воді, різного виду випромінювання, рослинні і тваринні мікро- і макроорганізми.
У виробничих експлуатаційних умовах кородування матеріалів викликається контактом з різного вигляду виробничими корозійно-активними середовищами і їх супроводжуючими мікроорганізмами, змінами температури і вогкості, обумовлювані технологічними процесами і т. д.
Руйнування матеріалів під безпосередньою дією рослинних і тваринних організмів, а також мікроорганізмів, називають біопошкодженнями.
У біопошкодженнях вищими рослинними організмами (обростанні, фітокоррозії) беруть участь не тільки коренева система (головним чином, кореневі волоски). Тваринні організми викликають біопошкодження матеріалів як безпосередньо своєю механічною дією (наприклад, гризуни — псують ізоляцію; птахи — пошкодження літальних апаратів при зіткненні з ними), так і продуктами своєї життєдіяльності, речовинами, що утворюються в результаті метаморфози екскрементів і унаслідок летального завершення свого життєвого циклу – гниття.
Органічними речовинами, одержуваними в результаті технологічного перероблення цих організмів: фруктовими і овочевими соками, рослинними маслами, кров'ю, м'ясним соком, тваринними жирами.
Агресивні середовища, що викликають органогенну корозію матеріалів, можуть бути як біогенного походження, так і не біогенного, наприклад, органічні речовини, що утворюються в (результаті технологічного перероблення нафти, кам'яного вугілля, сланців, вапняків-черепашників, а також вихлопні гази і кіптява дизельних і карбюраторних двигунів.
Корозія приводить до значних збитків у всіх промислово розвинених країнах, які складають приблизно 5-10% від національного доходу (у США ці збитки перевищують 70 млрд. доларів в рік). Вони складаються з багатьох окремих витрат.
Основні втрати від корозії обумовлені передчасним виходом з ладу металоконструкцій, вартість яких значно перевищує вартість металу, використаного на їх виготовлення. Сюди ж відносяться витрати на профілактичне обслуговування, ремонт і заміну окремих деталей. Друга найбільша стаття збитків обумовлена необхідністю здійснення комплексу заходів щодо боротьби з корозією.
Слід також відзначити, що корозія часто викликає непродуктивний простій устаткування, псування харчових і хімічних продуктів, втрату цих продуктів при порушенні герметичності, резервуарів або трубопроводів. Таким чином, витрати на боротьбу з корозією різноманітні і у кожному конкретному випадку вирішальною статтею збитків може стати будь-яка з приведених вище причин.
З розвитком промислового потенціалу у всіх країнах темп зростання корозійних втрат став перевищувати темп зростання металевого фонду. Це обумовлено, принаймні, двома основними причинами:
1. Зміною структури використовування металу. Якщо в двадцятому столітті основна частина металу споживалася залізничним транспортом, комунальним господарством і верстатобудуванням, то за останні десятиліття зросла питома вага металів в галузях, які використовують металовироби в агресивних середовищах (хімічна, нафтохімічна і паперово-целюлозна галузі промисловості, енергетика, автомобілебудування, авіація, морський флот).
2. Значним підвищенням агресивності атмосфери і природних вод унаслідок забруднення їх промисловими викидами.
Проблема корозії - це проблема підвищення експлуатаційно-технічної надійності і довговічності металоконструкцій, економічно вигідного використовування земних ресурсів і матеріальних засобів.
До важливих випадків корозії відносяться: корозія в газах (газова корозія) і корозія в розчинах електроліту (електрохімічна корозія ), до неї відноситься корозія в водних розчинах. Електрохімічна корозія протікає на поверхні металів під дією електричних струмів – це перенесення електродів в результаті утворення гальванічних мікроелементів у разі диференціації поверхні на катодні та анодні дільниці. Таким чином, кородуючий метал представляє собою багатоелектродний гальванічний елемент, що складається з центрального вугільного і зовнішнього цинкового електродів, розділених електролітом — розчином хлориду амонія (рис. 1.1). Лампочка, сполучена з обома електродами, горить, поки електрична енергія генерується хімічними реакціями на електродах. На вугільному електроді (позитивний полюс) йде реакція хімічного відновлення, на цинковому (негативний полюс) – окислення, (електрони з цинкового анода перетікають на вугільний катод, на якому електроди асимілюватимуться деполяризаторами (іонами водню)) при цьому металевий цинк перетворюється на гидратировані іони цинку Zn2+·nH2O. Чим більше потік електрики в елементі, тим більша кількість цинку кородує. Цей зв'язок описується кількісно законом Фарадея, відкритим на початку XIX століття:
m = k·t·I,
m (маса металу, що вступив в реакцію),
де I – сила струму, А;
t – час, с;
k – константа, звана електрохімічним еквівалентом (значення для цинку дорівнює 3,39·10–4 г∙Кл)
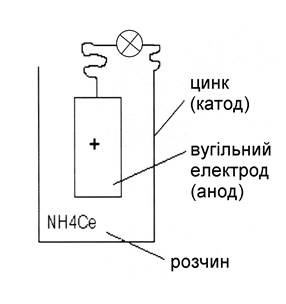
Рисунок 1.1-
Існують три основні типи елементів, що беруть участь в корозійних процесах.
1. До елементів з різнорідними електродами відноситься описаний раніше сухий елемент. Метал, що має електропровідні включення на поверхні наприклад: мідна труба, сполучена із залізною трубою, бронзовий гребний гвинт, що контактує із сталевим корпусом корабля – все це приклади корозійних елементів з різнорідними електродам. До цього типу елементів відносяться також нагартований метал у контакті з таким же відпаленим металом, монокристал металу певної орієнтації у контакті з монокристалом іншої орієнтації. Різні грані кристалів металу мають спочатку різні потенціали і, отже, різну схильність до корозії; при контакті металу з корозійним середовищем спостерігається тенденція до вирівнювання потенціалів.
2. У концентраційних елементах два однакові електроди контактують з розчинами різних складів. Існують два типи концентраційних елементів. Перший називається сольовим концентраційним елементом. Наприклад, якщо один мідний електрод занурений в концентрований розчин сульфату міді, а інший – в розбавлений (рис. 1.2), то при замиканні такого елементу мідь розчинятиметься з електроду, що знаходиться в розбавленому розчині (анод) і осідати на іншому електроді (катоді). Обидві реакції ведуть до вирівнювання концентрації розчинів. Інший тип концентрованого елементу, що має більше практичне значення – елемент диференціальної аерації. Прикладом може служити елемент з двох залізних електродів, занурених в розбавлений розчин NaCl, причому у одного електрода(катода) електроліт інтенсивно насищується повітрям а у іншого (анода) – азотом. Відмінність в концентрації кисню супроводжується виникненням різниці потенціалів, що обумовлює протікання струму (рис. 1.3). Виникнення елементу цього вигляду викликає руйнування в щілинах (щілинна корозія), що утворюються на стиках труб або в різьбових з'єднаннях, оскільки концентрація кисню в щілинах нижча, ніж зовні. Цим також пояснюється руйнування язви заліза під шаром вологи (рис. 1.4).
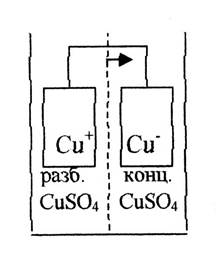
Рисунок 1.2-

Рисунок 1.3-
3. У термогальванічних елементах електрони з одного і того ж металу, що мають різну температуру, занурені в електроліт однакового складу.
У розчині сульфату міді мідний електрод при вищій температурі – катод, при низщій – анод. При замиканні елементу мідь осідає на гарячому електроді і розчиняється з холодного. Таким же чином поводиться свинець.
|

Рисунок 1.4-
Газова корозія протікає при контакті металів з газами в відсутності електропровідних розчинів.
У природних умовах газова корозія зустрічається рідко, а в технологічних процесах, особливо в металургійних і хімічних виробництвах при високих температурах – достатньо часто.
Як правило, газова корозія протікає по хімічному механізму.
Хімічна корозія металів – це мимовільний окислювально-відновний процес, що підкоряється законам гетерогенних хімічних реакцій, які здійснюються одночасно в одному акті в точці взаємодії металу з компонентом агресивного середовища. Метал в процесі хімічної корозії виступає в ролі відновника, він віддає електрони і окислюється. Компонент агресивного середовища виступає в ролі окислювача, в процесі реакції він відновлюється. У ролі окислювачів можуть бути О2,С12,НС1,SO2,СО2 і т. ін.
Приклад. У промисловості синтез хлористого водню з хлору і водню здійснюють при t=1000-1200°С. Якщо при цьому застосовують металеві печі, то внутрішня поверхня печі схильна до газової корозії. Залежно від вмісту хлору і водню в суміші газів протікають реакції:
Fe + C12 = FeC12 або 2Fe + 3C12 = 2FeC13. (1.2)
Залізо виступає як відновник, хлор - окислювач, а на поверхні металу утворюється сольова плівка.
Часто хімічний механізм корозії реалізується в рідкому середовищі неелектролітів.
По характеру корозійних уражень розрізняють суцільну або загальну корозію і місцеву корозію.
Неможливо дати загальну відповідь на питання про те, який вид корозійного руйнування найбільш небезпечний. Така відповідь може бути конкретною лише для строго певних умов експлуатації виробів. Наприклад, у разі силового елементу конструкції найбільш небезпечні міжкристалова корозія або корозійне розтріскування. Для резервуару, трубопроводу або реактора найбільш небезпечна точкова або виразкова корозія оскільки в цьому випадку герметичність порушується при появі хоча б одного крізного отвору. Для поверхонь тертя небезпечна суцільна корозія. Цей же вид корозії небезпечний для електричних контактів і високочастотних хвилеводів.
ПИТАННЯ:
1. Визначення поняття – корозія.
2. Основні статті збитків від корозії.
3. Причини темпів зростання втрат від корозії.
4. Суть корозійних процесів.
5. Типи основних елементів, що беруть участь в корозійних процесах.
6. Основні види корозії.
7. Характер корозійних уражень.
ЛІТЕРАТУРА
1. М.А. Шлугер і ін. Корозія і захист металів. М.1981.
2. Г.Г. Уліг, Р.У. Реві. Корозія і боротьба з нею. Переклад з англійської А.М. Сухотіним. Л.1989 р.
3. Л.І.Антропов та ін. Інгібітори корозії металів. К.1981 р.
Переглядів: 624