
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ОСНОВНІ ПОНЯТТЯ ХІМІЧНОЇ КІНЕТИКИ
ЗАГОРАННЯ
Горіння всіх речовин починається з їх займання. У більшості горючих речовин момент займання характеризується появою полум'я. У тих речовин, які горять без полум'я, наприклад, у термітних складів, які використовуються для зварювання металів, момент займання характеризується появою свічення. Відомі два види займання речовин – самозаймання і запалювання (вимушене займання). При самозаймання рівномірно нагрівається вся горюча суміш. При запаленні використовується явище розповсюдження фронту полум'я від місцевого відносного невеликого за розмірами джерела запалювання (полум'я, іскра, і т.п.).
Таким чином, запалювання являє собою два послідовних процесу – спочатку початкове осередкове запалення, яке викликає первинне полум'я, і потім поширення полум'я від джерела по всьому об'єму горючої суміші.
Наведемо короткі відомості з хімічної кінетики - науки про механізм і швидкості хімічних реакцій. Найважливіша величина – швидкість хімічної реакції – визначається зміною в часі кількості будь-якого з вихідних речовин або продуктів реакції в результаті хімічного перетворення. Хімічні реакції можуть протікати гомогенно (в обсязі однієї фази) або гетерогенно (на поверхні розділу фаз). Швидкість гомогенної реакції - це кількість речовини, що вступає в реакцію або утворюється в результаті реакції в одиницю часу в одиниці об'єму. Для реакцій, що протікають в системах постійного об’єму

де 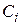 – концентрація i-го речовини,
– концентрація i-го речовини, 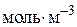 або
або 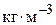 ;
;
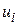 – швидкість реакції по i-му речовині,
– швидкість реакції по i-му речовині, 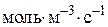 або
або 
Якщо i-а речовина – продукт реакції, то 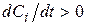 , вихідна речовина, то
, вихідна речовина, то 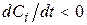 .
.
Хімічні реакції діляться на прості і складні. Проста реакція протікає в одному напрямку і в один етап; кінетична схема має такий вигляд
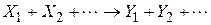
де 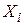 – вихідні речовини;
– вихідні речовини; 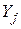 – продукти реакції.
– продукти реакції.
До складних належать оборотні реакції (одночасно протікають у двох протилежних напрямках)
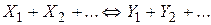
паралельні реакції, що описуються, в окремому випадку кінетичної схемою
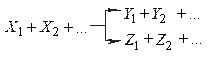
і послідовні реакції, наприклад
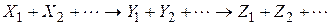
Для простої реакції можна записати стехіометричне рівняння
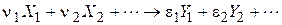
де 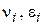 - стехіометричні коефіцієнти, відповідно рівні числам молекул вихідних речовин і продуктів реакції, що беруть участь в елементарному процесі.
- стехіометричні коефіцієнти, відповідно рівні числам молекул вихідних речовин і продуктів реакції, що беруть участь в елементарному процесі.
Стехіометричне рівняння дозволяє встановити зв’язок між швидкостями простої реакції з різних компонентів:
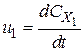 ;
; 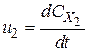 ;
; 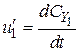 ;
; 
При квазістаціонарному протіканні процесу всі вихідні речовини повинні зникати, а продукти - з’являтися в результаті хімічної реакції в еквівалентних кількостях, тобто повинно задовольнятися умова стехіометрії:

Чим більша величина , тим більше по модулю повинна бути швидкість реакції 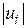 або
або  (тобто при більшому значенні стехіометричного коефіцієнта більша кількість відповідної речовини реагує в одиницю часу). Звідси випливає, що незалежно від вибору речовини, швидкість реакції можна охарактеризувати величиною
(тобто при більшому значенні стехіометричного коефіцієнта більша кількість відповідної речовини реагує в одиницю часу). Звідси випливає, що незалежно від вибору речовини, швидкість реакції можна охарактеризувати величиною

Величина 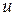 називається швидкістю простої реакції без відношення до будь-якого конкретного компоненту. Швидкість простої реакції підкоряється закону діючих мас
називається швидкістю простої реакції без відношення до будь-якого конкретного компоненту. Швидкість простої реакції підкоряється закону діючих мас
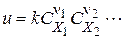
де k - константа швидкості реакції, чисельно рівна її швидкості при поодиноких концентраціях. Підкреслимо, що в це рівняння входять тільки концентрації вихідних речовин в ступені їх стехіометричних коефіцієнтів.
Сума стехіометричних коефіцієнтів 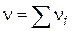 , що дорівнює кількості молекул, що беруть участь в одиничному акті, називається стехіометричним порядком (молекулярна) реакції:
, що дорівнює кількості молекул, що беруть участь в одиничному акті, називається стехіометричним порядком (молекулярна) реакції:
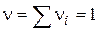 - Мономолекулярна реакція;
- Мономолекулярна реакція;
 - Бімолекулярний реакція;
- Бімолекулярний реакція;
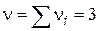 - Трімолекулярная реакція.
- Трімолекулярная реакція.
Стехіометричний порядок простої реакції - завжди ціле число (не дрібне) і не перевищує трьох (ймовірність одночасного зіткнення більш ніж трьох молекул близька до нуля). Застосовувати закон діючих мас для розрахунку складних реакцій можна для одностадійної оборотної реакції, швидкість якої
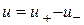
де  ,
,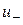 - Швидкості реакції в прямому і зворотному напрямках.
- Швидкості реакції в прямому і зворотному напрямках.
За законом діючих масс
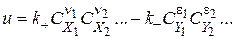
де, 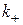 ,
,  - константи швидкості прямої і зворотної реакцій.
- константи швидкості прямої і зворотної реакцій.
При величині u = 0, що відповідає хімічному рівноваги системи.
У загальному випадку для опису складної реакції потрібно кілька стехіометричних рівнянь. Складаючи їх, отримуємо брутто-рівняння реакції, що описує процес в цілому, але не відображає істинного механізму хімічних перетворень. Для складної реакції можна (на основі експериментів) записати рівняння, що зв'язує швидкість реакції з концентрацією вихідних речовин (кінетичне рівняння)
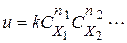
де 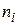 - порядок реакції по i -му речовині;
- порядок реакції по i -му речовині; 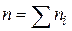 - порядок реакції (кінетичний порядок реакції).На відміну від
- порядок реакції (кінетичний порядок реакції).На відміну від 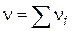 кінетичний порядок реакції n може бути дробовим числом. Розмірність константи швидкості реакції k залежить від її порядку:
кінетичний порядок реакції n може бути дробовим числом. Розмірність константи швидкості реакції k залежить від її порядку:
для 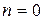 ,
, 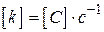 ;
;
для 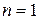 ,
, 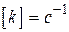 ;
;
для  ,
, 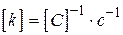 ,
,
де 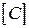 - прийнята розмірність концентрації. Різниця в розмірності константи швидкості реакції
- прийнята розмірність концентрації. Різниця в розмірності константи швидкості реакції 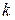 пов'язано з тим, що розмірність швидкості реакції завжди повинна бути
пов'язано з тим, що розмірність швидкості реакції завжди повинна бути 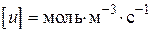 або.
або. 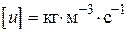 .
.
Швидкість переважної більшості реакцій (простих і складних) підвищується з ростом температури Т, а константа швидкості реакції підпорядковується закону Арреніуса
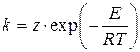
де z - предекспонент (предекспоненціальний множник, частотний фактор), розмірність якого дорівнює розмірності константи швидкості реакції [z] = [k];
Т - абсолютна температура, К;
E - енергія активації реакції, Дж×моль-1;
R0 = 8.3134 Дж×К-1×моль-1- Універсальна газова стала.
Безрозмірний показник експоненти в законі Арреніуса називається критерієм Арреніуса:
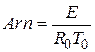
де 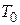 - характерна температура.
- характерна температура.
Цей критерій виражає чутливість швидкості хімічної реакції до зміни температури. Чим вище значення Arn, тим сильніше ця чутливість. Вхідні в закон Арреніуса величини z і E називаються кінетичними константами хімічної реакції. Фізичний сенс енергії активації Е для простої реакції полягає в тому, що це енергія, якою повинна володіти молекула для того, щоб вступити в реакцію. Для складних реакцій Е не має простого фізичного сенсу. Значення z, Е визначаються, як правило, експериментальним шляхом. Кінетичні константи повністю визначають швидкість протікання кожної конкретної реакції, в тому числі і реакції займання або горіння. Завдання експериментального визначення цих констант є найважливішою при дослідженні фізико-хімічних процесів в високоенергетичних установках.
Хімічна реакція проходить з виділенням тепла (екзотермічна реакція), або з його поглинанням (ендотермічна реакція). Якщо пряма реакція - екзотермічна, то зворотна - ендотермічна. Кількість тепла, що виділяється при повному реагуванні одиниці кількості речовини (1 моль або 1 кг), називається тепловим ефектом реакції. Розмірність теплового ефекту реакції 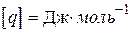 або
або 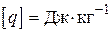 .
.
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Поняття соціального процесу.
- V. Поняття та ознаки (характеристики) злочинності
- А/. Поняття про судовий процес.
- Аварійне та довгострокове прогнозування хімічної обстановки
- Адвокатура в Україні: основні завдання і функції
- Адміністративний проступок: поняття, ознаки, види.
- Адміністративні провадження: поняття, класифікація, стадії
- Акти застосування юридичних норм: поняття, ознаки, види.
- Амортизація основних засобів, основні методи амортизації
- Аналіз ступеня вільності механізму. Наведемо визначення механізму, враховуючи нові поняття.
- Артеріальний пульс, основні параметри
| <== попередня сторінка | | | наступна сторінка ==> |
| Закони царя Хамураппі | | | Самозапалювання |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |