
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
IV група катіонів
1. Реакції катіонів Cr3+
1.1. Їдкі луги осаджують іони Cr3+ у вигляді гідроксиду сіро-зеленого кольору, що розчиняється у кислотах і надлишку лугів. Зафіксуйте забарвлення розчинів і напишіть рівняння реакцій.
1.2. Гідроксид амонію осаджує гідроксид хрому (ІІІ), який розчиняється у надлишку реактиву з утворенням гексаамінохрому (ІІІ). Складіть рівняння реакції розчинення.
1.3. Гідрофосфат натрію утворює з катіонами Cr3+ осад фосфату хрому. Який колір осаду? Складіть рівняння реакції. Напишіть рівняння реакцій розчинення фосфату хрому у кислоті та лузі.
1.4. Характерною реакцією на іони Cr3+ є окиснення їх до СrO42-. До 3–5 краплин розчину солі хрому (ІІІ) прилийте надлишок лугу до розчинення осаду, що спочатку утворився. Потім до розчину додайте 6–8 краплин 6%-вого розчину пероксиду водню і нагрівайте його до зміни забарвлення. Що спостерігається? Складіть рівняння реакції окиснення. Що відбудеться, якщо окиснення проводити в кислому середовищі?
2. Реакції катіонів Al3+
2.1. Їдкі луги, гідроксид амонію, гідрофосфат натрію взаємодіють з солями алюмінію подібно до солей хрому (ІІІ). У чому полягає різниця? Складіть рівняння відповідних реакцій і запишіть спостереження.
2.2. Гідроліз солей алюмінію.
Візьміть шпателем невелику кількість сульфату або нітрату алюмінію, перенесіть у пробірку і додайте декілька краплин води. За допомогою універсального індикаторного паперу визначте рН розчину. Напишіть рівняння гідролізу. Поясніть, чому при взаємодії солі алюмінію з солями амонію (а також хрому (ІІІ)) утворюється не сульфід, а гідроксид і сірководень.
2.3. Характерна реакція на іони Al3+ з алізарином (1,2- діоксоантрахіноном - С14Н6О2(ОН)2):
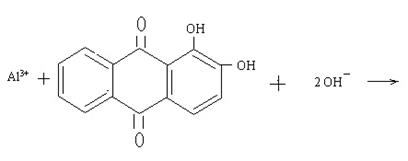
|
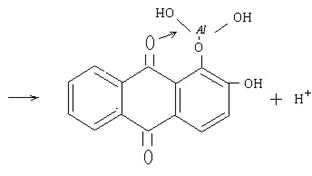
Реакцію проводять у присутності гідроксиду амонію. Для виконання якісної реакції до солі алюмінію додайте 3–4 краплини розчину гідроксиду амонію до отримання лужної реакції за індикаторним папірцем. До одержаного осаду додайте декілька краплин розчину алізарину. Утворюється внутрішньокомплексна сіль оранжево-червоного кольору, яку називають алізарин-алюмінієвим лаком.
3. Реакції катіонів Zn2+
3.1. Їдкі луги утворюють з катіонами Zn2+ осад, розчинний у кислотах і надлишку лугу, а також у розчині аміаку. Складіть відповідні рівняння.
3.2. Гексаціаноферат (ІІ) калію вступає в обмінну реакцію з солями цинку:
3ZnSO4 + 2K4[Fe(CN)6] = K2 Zn3[Fe(CN)6]2¯ + 3K2SO4 .
Складіть іонне рівняння цієї реакції. Який вигляд має осад? Чому ця реакція дозволяє розрізнити катіони Zn2+ і Al3+?
3.3. Реакція з нітратом кобальту
На шматочок фільтрувального паперу нанесіть розчини нітратів цинку і кобальту. Папір спаліть. Зола, що утворюється, забарвлена в зелений колір (зелень Рінмана):
Zn(NO3)2 + Co(NO3)2 = CoZnO2 + 4NO2 + O2 .
3.4. Реакція з дитизоном (дифенілтіокарбазоном) є характерною на іони Zn2+.
При додаванні хлороформного розчину дитизону до водного розчину солі цинку утворюється дитизонат цинку, що забарвлює і хлороформний, і водний шар у червоний колір. Проте забарвлення лише органічного шару ще не є доказом присутності іонів Zn2+.
Для виконання реакції внесіть у пробірку 2–3 краплини розчину солі цинку, сюди ж додайте 5 краплин 2 н розчину гідроксиду натрію і 2–3 краплини розчину дитизону. Ретельно перемішайте розчин скляною паличкою.
Реакція відбувається за схемою:
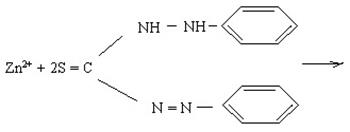
|
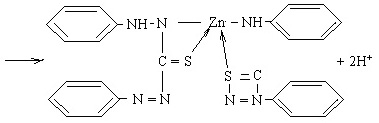
4. Реакції катіонів Sn2+
4.1. Їдкі луги з катіонами Sn2+ реагують подібно катіонам Zn2+. Складіть рівняння реакцій утворення і розчинення осаду гідроксиду олова (ІІ) у кислотах та у надлишку лугу.
4.2. Гідроксид амонію утворює з катіонами Sn2+ осад, нерозчинний у надлишку осаджувача. Зробіть порівняння з катіонами Zn2+?
4.3. Сполуки олова (ІІ) мають різко виражені відновні властивості та здатні відновлювати вільні метали з солей ртуті, срібла, міді, свинцю, золота, платини та інших. Виконайте реакцію:
SnCl2 + HgCl2 = Hg¯ + SnCl4 .
Що спостерігається?
4.4. Характерною реакцією на іони Sn2+ є взаємодія з розчином солі вісмуту (ІІІ). До 0,5–1 см3 розчину солі олова (ІІ) додайте подвійний об'єм 2 н розчину гідроксиду натрію і обережно перемішайте. Потім по стінці пробірки додайте 2–3 краплини розчину солі вісмуту (ІІІ). У місці контакту розчинів утворюється чорний вінчик металевого вісмуту. Складіть рівняння реакцій одержання станіту натрію і взаємодії його з сіллю вісмуту (ІІІ) у лужному середовищі.
5. Реакції іонів Sn (IV)
5.1. Їдкі луги, гідроксид амонію і карбонати лужних металів утворюють з іонами олова (IV) білий драглистий осад гідроксиду олова, який ще має назву a-олов'яної кислоти:
[SnCl6]2- + 4OH- = Sn(OH)4¯ + 6Cl-.
Запишіть рівняння реакцій розчинення a-олов’яної кислоти у кислоті та лузі.
5.2. Гідроліз солей Sn (IV).
Гідроліз солей Sn (IV) відбувається при рН=1,5 за схемою:
H2SnCl6 + 2H2O = SnO2↓+ 6HCl .
5.3. Іони олова (IV) не мають характерних реакцій, тому вони виявляються за допомогою характерної реакції іонів Sn2+ після попереднього відновлення, наприклад, за схемою:
H2[SnCl6] + Fe = SnCl2 + FeCl2 + 2HCl ,
SnCl2 + 4NaOH = Na2SnO2 + 2NaCl + 2H2O ,
FeCl2 + 4NaOH = Fe(OH)2¯ + 2NaCl .
Осад Fe(OH)2 відфільтруйте і у фільтраті визначте іони Sn2+ за реакцією з солями Bi (III) (див. п. 4.4).
6. Реакції іонів As (III) і As (V)
У ході аналізу As (III) і As (V) розглядають як катіони, хоча арсен насправді знаходиться у складі аніонів AsO33-і AsO43-або ацидокомплексів.
6.1. Нітрат срібла утворює з солями As (III) жовтий осад ортоарсеніту срібла, розчинного в азотній кислоті і гідроксиді амонію. Складіть рівняння відповідних реакцій.
6.2. Розчин йоду у слабко лужному середовищі (гідрокарбонат натрію) окиснює іони AsO33-:
Na3AsO3 + I2 + H2O = Na3AsO4 + 2HI .
Що спостерігається при поступовому додаванні йоду?
6.3. Нітрат срібла утворює з солями As (V) осад ортоарсенату, розчинний в HNO3 і NH4OH.Складіть рівняння реакцій. Чи відрізняється за кольором цей осад від Ag3AsO3?
6.4. При взаємодії йодиду калію з іонами AsO43-у кислому середовищі відбувається реакція, зворотня реакції, наведеній у п. 6.2. Складіть її рівняння і запишіть спостереження.
6.5. Магнезіальна суміш (MgCl2 + NН4Cl + NH4OH) утворює з іонами AsO43-осад, розчинний у кислотах:
Na3AsO4 + MgCl2 + NH4OH = MgNH4AsO4¯ + 2NaCl + +NaOH .
Який вигляд має цей осад?
6.6. Характерною на іони AsO43-є реакція з молібденовою рідиною:
(NH4)3AsO4 + 12(NH4)2МоО4 +24HNO3 = (NH4)3[As(Mo3O10)4]¯ + + 24NH4NO3+ 12Н2О.
Зафіксуйте колір осаду. Складіть іонне рівняння реакції.
Контрольні питання, запитання та завдання
1. Складіть схему систематичного аналізу суміші катіонів І та ІІ аналітичних груп.
2. Чому іони амонію слід визначити першими, а потім їх видаляти з суміші, що аналізується?
3. Чому для відкриття іонів Na+ краще застосовувати цинкуранілацетат?
4. Яка властивість хлориду та йодиду свинцю дозволяє виділити з суміші і виявити катіон Pb2+?
5. Чим зумовлено почорніння осаду при визначенні катіонів Hg22+? Поясніть за допомогою рівняння реакції.
6. У чому полягає роль аміаку та азотної кислоти при визначенні катіонів срібла? Складіть рівняння відповідних реакцій.
7. Чому дорівнює добуток розчинності карбонату кальцію, якщо відомо, що розчинність цієї солі становить 0,013 г/дм3?
8. Чому дорівнює розчинність гідроксиду магнію (у моль/дм3 і г/дм3) при температурі 25°С, якщо його добуток розчинності становить 5·10-12?
9. Чи випаде осад сульфату стронцію при змішуванні рівних об'ємів 0,001 М розчинів хлориду стронцію i сульфату калію, якщо добуток розчинності сульфату стронцію становить 2,8·10-7?
10. В якій послідовності будуть осаджуватись іони Ba2+, Ca2+ та Sr2+ під дією карбонату амонію, якщо їх концентрації у розчині однакові?
11. Чому хлорид срібла розчиняється, а йодид срібла не розчиняється у концентрованому розчині аміаку? Висновок зробіть, користуючись значеннями добутків розчинності і константами нестійкості комплексу.
12. Чим можна пояснити, що гіпсова вода осаджує іони стронцію? Чому при їх визначенні необхідно попередньо осадити Ba2+ у вигляді хромату?
13. При визначенні катіонів Ba2+ додають ацетат натрію. Поясніть необхідність цього за допомогою рівняння реакції.
14. В які кольори забарвлюють полум'я газового пальника леткі сполуки, що містять катіони ІІІ групи? Складіть таблицю.
15. Визначте концентрацію іонів водню у розчині, рН якого становить 4,6. Чому дорівнює концентрація гідроксид-іонів у цьому розчині?
16. Як зміниться рН 2 М розчину соляної кислоти, якщо його вдвічі розвести водою?
17. Наведіть декілька прикладів із попередніх робіт, які підтверджують вплив значень рН на перебіг аналітичних реакцій у необхідному напрямку.
18. За допомогою двох рівнянь реакцій, складених у молекулярному та іонному вигляді, доведіть амфотерність гідроксиду олова (ІІ).
19. При розділенні та відкритті яких катіонів використовують амфотерність їх гідроксидів?
20. Чому катіон Pb2+ належить до ІІ, а не до ІV групи, хоча його гідроксид амфотерний?
21. Записи – Sn4+ і As5+ – не є правильними та іноді вживаються лише умовно. Поясніть чому.
| <== попередня сторінка | | | наступна сторінка ==> |
| ІІІ група катіонів | | | Лабораторна робота 1.3 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |