
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Порядок і рекомендації щодо виконання роботи
1. Визначення вмісту заліза (ІІ) у солі Мора або у залізному купоросі
Визначення заліза (ІІ) проводять прямим титруванням його перманганатом калію у середовищі сірчаної кислоти:
5Fe 2+ + 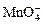 + 8H + = 5Fe3++ Mn2+ + 4H2O .
+ 8H + = 5Fe3++ Mn2+ + 4H2O .
До розчину солі заліза (ІІ), що знаходиться у мірній колбі, додайте дистильовану воду до позначки і ретельно перемішайте. Піпеткою відберіть аліквотнучастину цього розчину і перенесіть у конічну колбу для титрування. Розчин підкисліть 2 н розчином сірчаної кислоти (8 см3 H2SO4 на 10 см3 розчину ) і титруйте на холоді розчином перманганату калію до появи стійкого рожевого забарвлення. Щоб іони заліза (ІІ) не окиснювались киснем, треба уникати тривалого контакту розчину з повітрям. Проведіть розрахунок нормальності Fe2+ у розчині, що аналізується, маси заліза (ІІ) у пробі і маси солі Мора або залізного купоросу.
2. Визначення пероксиду водню
Перманганатометричний метод визначення пероксиду водню базується на окисненні його до вільного кисню згідно з рівнянням реакції:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 +8 H2O .
З рівняння видно, що
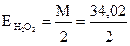 = 17,01 г/моль.
= 17,01 г/моль.
Одержаний для аналізу розчин пероксиду в мірній колбі розведіть водою до позначки і перемішайте. Відберіть для титрування аліквотну частину, додайте розчин сірчаної кислоти як в попередньому випадку і повільно титруйте робочим розчином перманганату калію до появи стійкого блідо-рожевого забарвлення. Знайшовши за результатами трьох титрувань об’єм перманганату калію, розрахуйте нормальність і масу пероксиду водню у виданому розчині.
Виміри і розрахунки
Порядок запису вимірів і проведення розрахунків аналогічний описаному в розділі 3 лабораторної роботи 3.1.
Контрольні питання, запитання та завдання
1. Чим визначається величина стрибка на кривій окисно-відновного титрування? Яким чином її можна збільшити?
2. Наведіть приклади індикаторів, які специфічно взаємодіють з однією з форм окисно-відновної пари.
3. Наведіть приклади окисно-відновних індикаторів.
4. Чому титрування солей заліза (ІІ) і пероксиду водню необхідно виконувати на холоді? Напишіть рівняння реакцій, які можуть відбуватися з цими речовинами при нагріванні.
5. Яку помилку допущено в ході аналізу, якщо під час титрування перманганатом калію розчин помутнів?
6. Обчисліть молярні маси еквівалентів солі Мора (NH)2Fe(SO4)2∙6H2O і залізного купоросу FeSO4∙7H2O.
7. У 200 см3 розчину знаходиться 0,25 г пероксиду водню. Яка нормальність розчину перманганату калію, якщо на титрування 20,0 см3 розчину пероксиду водню витрачено 24,6 см3 розчину перманганату калію?
8. Для визначення заліза наважка глини 0,8644 г переведена в розчин і перенесена в мірну колбу ємністю
250 см3. В 100 см3 одержаного розчину іони Fe3+ відновлені до Fe2+ і на титрування витрачено 9,5 см3 0,01 н KMnO4. Розрахувати масову частку Fe2O3 в пробі.
9. У якості стандарту в перманганатометрії використовують чисте металічне залізо. Яка нормальність перманганату, якщо на титрування 0,5585 г переведеного у Fe2+ витрачається 33,0 см3 KMnO4?
10. Зразок гірської породи (1,0000 г) розчиняють, залізо, яке знаходиться в ній, відновлюють до Fe2+ і титрують дихроматом. Який вміст (%) Fe2O3 у зразку, якщо на титрування витрачається 12,4 см3 0,050 н розчину дихромату калію?
| <== попередня сторінка | | | наступна сторінка ==> |
| Лабораторна робота 4.2 | | | Лабораторна робота 4.3 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |