
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Основні рівняння і символи
Хімічна кінетика вивчає швидкість реакції, залежність швидкості від зовнішніх факторів, а також механізм протікання реакцій.
Швидкістю хімічної реакції (W) називають зміну кількості реагуючої речовини (m, моль), що прореагувала за одиницю часу (τ) в одиниці реакційного простору(V).
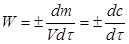 (2.1)
(2.1)
де с=m/V – концентрація реагенту (моль/м3); знак "+" відповідає розрахунку швидкості за продуктом реакції, кількість якого зростає з часом, знак "-" – при розрахунку швидкості за зміною концентрації вихідної речовини, кількість якої з часом спадає. Якщо вимірювати концентрацію в моль/м3, а час в секундах, то розмірність швидкості буде - моль·м-3·с-1.
Кількісна залежність швидкості реакції від концентрації виражається основним постулатом хімічної кінетики (законом дії мас): швидкість гомогенної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин, кожна з яких піднесена до степеня, що дорівнює їх стехіометричним коефіцієнтам у рівнянні реакції.
Для реакції aA + bB→ продукти реакції швидкість згідно закону дії мас може бути записана у вигляді
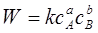 (2.2)
(2.2)
Сума показників степенів при концентраціях реагуючих речовин в кінетичному рівнянні називається порядком реакції(р)
р = а + b (2.3)
Швидкість реакцій нульового порядку є величиною сталою в часі:
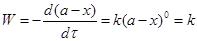 (2.4)
(2.4)
де а – кількість молів вихідної речовини (чи концентрація) на початку реакції; х кількість молів речовини, що прореагувало на момент часу τ; k – константа швидкості реакції.
Розділення змінних та інтегрування рівняння приводить до виразу: х = kτ
Кількість продукту реакції нульового порядку лінійно зростає з часом, а константа реакції нульового порядку дорівнюватиме
k = x/τ (2.5)
Розмірність константи швидкості нульового порядку [моль/с].
Час, за який реакція проходить наполовину (τ1/2) – напівперіод реакції -(х=а/2) для таких реакцій прямопропорційний вихідній кількості реагентів
τ1/2 = а/(2k) (2.6)
Для необоротної реакції першого порядку ( А → В) диференціальна форма кінетичного рівняння має вигляд:
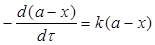
Розв'язок цього виразу відносно k дає інтегральну форму рівняння для константи швидкості необоротної реакції першого порядку:
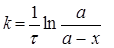 (2.7)
(2.7)
Розмірність константи швидкості першого порядку [1/с].
Час напіврозпаду реакцій першого порядку не залежить від кількості вихідної речовини.
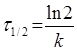 (2.8)
(2.8)
|
А → В → С
Перша стадія реакції являє собою необоротну реакцію першого порядку і описується рівнянням: 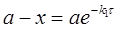
Кінетичне рівняння для проміжної речовини має вигляд:
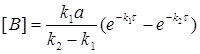 (2.9)
(2.9)
Кількість кінцевого продукту реакції як функцію часу можна визначити за рівнянням:
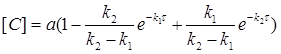 (2.10)
(2.10)
Час досягнення максимальної концентрації проміжної речовини “В” (τмакс) визначають за формулою:
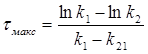 (2.11)
(2.11)
Реакції другого порядку проходять за схемою А + В → С.
Якщо вихідні кількості речовин А і В однакові [A]=[B]=a, то диференціальне рівняння швидкості реакції можна записати
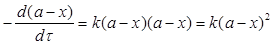
Інтегральне кінетичне рівняння має вигляд
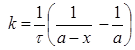 чи
чи 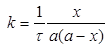 [с-1моль-1 ]
[с-1моль-1 ]
Час напіврозпаду дорівнює 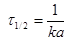 .
.
Диференціальне рівняння швидкості односторонньої бімолекулярної реакції з нееквімолярним співвідношенням кількості вихідних реагентів можна записати
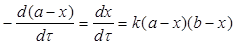
де а і в (а ≠ в) – вихідні кількості речовин А і В.
Константа швидкості такої реакції другого порядку становитиме
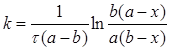 (2.12)
(2.12)
Розмірність константи швидкості нульового порядку [с-1моль-1].
Рівняння реакції n-го порядку можна зобразити
А1 + А2 + · · · + Аn → продукти реакції
Якщо концентрації вихідних реагентів однакові, то кінетичне рівняння в диференціальній формі має вигляд:
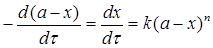
Після розділення змінних і інтегрування в межах зміни кількості речовин від 0 до х а часу від 0 до τ одержимо
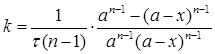
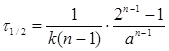 (2.13)
(2.13)
Інтегральний метод визначення порядку реакції за часом половинного перетворення (метод Оствальда-Нойєса) базується на дослідженні співвідношення між початковою концентрацією (чи кількістю молів) вихідних речовин і часом половинного перетворення  :
:
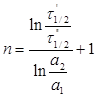 (2.14)
(2.14)
де τ'1/2 i τ''1/2 час половинного перетворення для двох різних початкових концентрацій а1 і а2 відповідно.
Аналітично можна визначити порядок реакції і. за диференціальним методом Вант-Гоффа за формулою:
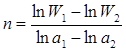 (2.15)
(2.15)
де W1 і W2 - швидкості реакції при відповідних значеннях концентрацій реагентів (чи їх кількості молів) – а1 і а2.
Залежність константи швидкості реакції від температури наближено виражається за правилом Вант-Гоффа (правило справедливо в області кімнатних температур):
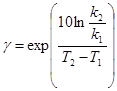 (2.16)
(2.16)
де k1 і k2 – константи швидкості реакції за температур Т1 і Т2;
γ – температурний коефіцієнт швидкості реакції (Вант-Гоффа); γ = 2÷4.
Залежність константи швидкості від температури в широкому діапазоні температур описується рівнянням Арреніуса в диференціальній формі:
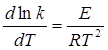 (2.17)
(2.17)
Величина Е, що входить в рівняння Арреніуса, має розмірність енергії в розрахунку на один моль частинок і є енергією утворення одного моля активної структури, здатної до хімічного перетворення, яку називають енергією активації реакції.
Після розділення змінних і інтегрування невизначеним інтегралом одержуємо рівняння Арреніуса в інтегральній формі
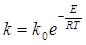 (2.18)
(2.18)
де k0 – передекспонентний множник це коефіцієнт, що дорівнює константі швидкості за Т → ∞.
Однією з основних задач хімічної кінетики є знаходження алгоритму розрахунку константи швидкості елементарної реакції і та її залежності від температури, використовуючи уявлення про будову реагентів і шляхи реакції.
Теорія активних зіткненьбазується на підрахунку числа зіткнень між реагуючими частинками, яки розглядаються у вигляді твердих сфер. Припускається, що зіткнення приведе до реакції, якщо виконуються дві умови: 1) енергія частинок, між якими відбувається зіткнення, рівна, чи перевищує енергію активації реакції (E); 2) частинки певним чином зорієнтовані в просторі. Перша умова вводить у вираз константи швидкості множник ехр(-Е/RT), який дорівнює частці активних зіткнень з загального числа зіткнень. Друга умова – так званий стеричний множник (стеричний фактор) "Р"– константу, характерну для даної реакції.
Якщо у реакції беруть участь молекули одного виду (А + А → продукт), то згідно положень молекулярно-кінетичної теорії газів кількість зіткнень за 1 секунду в 1 м3 (Z0) буде задаватися виразом
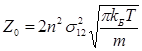 (2.19)
(2.19)
де n – число молекул в 1 м3; σ12 – діаметр молекул А, m – маса частинок (кг); kБ – стала Больцмана (kБ = 1.38·10-23 Дж/К); Т – температура, К.
Якщо в системі реагують молекули двох різних видів(А + В → продукт), то
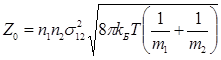 (2.20)
(2.20)
де n1, n2 – число молекул А і В в 1 м3 ; m1, m2 – маса частинок А і В (кг); σ12 середній ефективний діаметр зіткнення (м).
За законом розподілу Максвелла-Больцмана число зіткнень активних молекул (Z) визначається співвідношенням
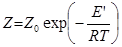 (2.21)
(2.21)
де Е' – істинна енергія активації.
Ефективна енергія активації (Е) відрізняється від істинної (Е') на величину середньої енергії теплового руху молекул:
Е = Е' + 0.5RT (2.22)
Константа швидкості реакції згідно положень теорії активних зіткнень для мономолекулярної реакції дорівнює:
k = 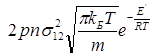 (2.23)
(2.23)
де р – стеричний фактор, який враховує розбіжність між експериментальними і розрахунковими значеннями, пов'язаними з тими спрощеннями, що прийняті теорією щодо процесів зустрічі частинок і просторових уявлень про реагуючі молекули.
Для бімолекулярної реакції константа швидкості дорівнює:
k = 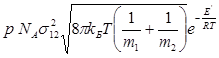 (2.24)
(2.24)
NA – число Авогадро, ( NA = 6.023·1023 моль-1).
Основне положення теорії активного комплексу (теорії абсолютних швидкостей) полягає в припущенні, щохімічна реакція проходить через утворення активного комплексу, який розкладається на продукти реакції. Припускається, що між вихідними реагентами і активним комплексом існує квазірівновага:



 вихідні реагенти активний комплекс продукти
вихідні реагенти активний комплекс продукти
Константа швидкості реакції в теорії активного комплексу має вигляд:
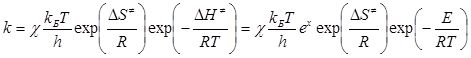 (2.25)
(2.25)
де χ – трансмісійний множник чи коефіцієнт проходження, який дорівнює частці активованих комплексів, що розкладаються на продукти реакції; kB – стала Больцмана; Т – температура К; h – стала Планка;, 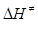 і
і 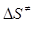 - стандартні зміни ентальпії і ентропії процесу утворення активного комплексу; Е - енергія активації реакції; х =1 для мономолекулярних, х=2 для бімолекулярних реакцій.
- стандартні зміни ентальпії і ентропії процесу утворення активного комплексу; Е - енергія активації реакції; х =1 для мономолекулярних, х=2 для бімолекулярних реакцій.
Рівняння зв’язку між енергією активації і зміною ентальпії при утворенні активного комплексу має вигляд:
Е = 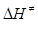 + хRT. (2.26)
+ хRT. (2.26)
Передекспонентний множник в рівнянні Арреніуса згідно положень теорії активного комплексу дорівнює:
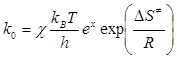 (2.27)
(2.27)
Ланцюговиминазиваються реакції в яких виникнення активних частинок ініціює певну кількість наступних перетворень неактивних молекул внаслідок регенерації активної частинки в кожному наступному елементарному акті хімічної реакції.
Якщо позначити через n – кількість активних частинок, існуючих в реакційній суміші на момент часу τ; t – середній час життя активної частинки; β=1/ ν – ймовірність обриву ланцюга (обернено пропорційна його довжині); δ – ймовірність розгалуження ланцюга; n0 – кількість активних частинок, що утворюються в суміші за одиницю часу під дією зовнішнього джерела (незалежно від механізму реакції), то:
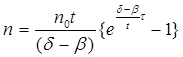 (2.28)
(2.28)
Швидкість такої реакції дорівнює:
w = n/t = 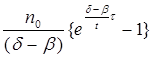 (2.29)
(2.29)
Фотохімічними називаються реакції, що протікають під дією світла. На відміну від так званих термічних реакцій, де енергія (рівна енергії активації) забезпечується за рахунок кінетичної енергії молекул реагентів, у випадку фотохімічних реакцій додаткова енергія передається системі за рахунок потоку квантів світла від джерела електромагнітного випромінювання.
Енергія випромінювання, що поглинається шаром речовини товщиною l і кількістю молекул речовини в одиниці об'єму n в одиницю часу - Q, можна розрахувати як різницю між інтенсивністю падаючого світла і світла, що пройшло через реакційне середовище
Q = J0 – J = J0 (1 – e-knl) (2.30)
де J0 – інтенсивність падаючого на систему світлового потоку, J – інтенсивність світлового потоку після взаємодії з реагентами, k – молярний коефіцієнт поглинання, n – число поглинаючих світло молекул в одиниці об'єму, l – товщина поглинаючого шару системи.
Тоді згідно закону Вант-Гоффа швидкість фотохімічної реакції (- dn/dτ) пропорційна кількості світлової енергії, що поглинається речовиною в одиницю часу: w= 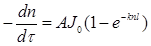 (2.31)
(2.31)
де А – коефіцієнт пропорційності.
Згідно з законом фотохімічної еквівалентності Ейнштейна-Штарка кожному поглинутому кванту випромінювання hv відповідає одна змінена частинка.
Число квантів, що поглинається в одиницю часу (n0) дорівнює
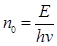 (2.32)
(2.32)
де Е – кількість світлової енергії, що поглинає система в одиницю часу;
hv - енергія одного кванта.
Досліди засвідчують, що у багатьох випадках число молекул, що прореагували фотохімічно, не дорівнює числу поглинутих квантів. Тому для характеристики фотохімічних реакцій ввели поняття квантового виходу. Квантовим виходом (γ) називають відношення числа молекул, що прореагували під дією світла (np), до числа поглинутих квантів (n0).
γ = 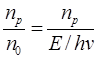 (2.33)
(2.33)
Швидкість хімічної реакції згідно закону фотохімічної еквівалентності Ейнштейна-Штарка дорівнює:
w= 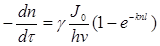 (2.34)
(2.34)
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Приклади розв’язку типових задач |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |