
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Контрольні задачі
1. Для реакції 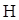 2(г) + Ar(г) = 2
2(г) + Ar(г) = 2 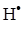 (г) + Ar(г) , що відбувається за температури 3000 К, константа швидкості дорівнює k = 2.2·104 л/(моль·с). Чому дорівнює швидкість реакції, якщо концентрації вихідних реагентів становлять:
(г) + Ar(г) , що відбувається за температури 3000 К, константа швидкості дорівнює k = 2.2·104 л/(моль·с). Чому дорівнює швидкість реакції, якщо концентрації вихідних реагентів становлять: 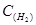 =4.1·10-3моль/л,
=4.1·10-3моль/л, 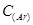 = 4.1·10-4моль/л ?
= 4.1·10-4моль/л ?
2Перетворення перекису бензоілу у діетиловий етер відбувається за першим порядком. За температури 60 0С реакція за 10 хвилин проходить на 75.2%. Розрахуйте константу швидкості реакції.
3. Хімічна реакція відбувається за нульовим порядком. За який час концентрація вихідної речовини зміниться від 4·10-2 моль/л до 2·10-2 моль/л, якщо константа швидкості реакції становить k = 5·10-8 моль/(л·с)?
4. Константа швидкості бімолекулярної реакції 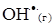 +
+ 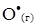 =
= 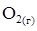 +
+ 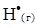 дорівнює k = 1.3·1010 моль/(л·с). Порівняйте початкові швидкості реакції, якщо вихідні концентрації реагентів в першому випадку дорівнюють
дорівнює k = 1.3·1010 моль/(л·с). Порівняйте початкові швидкості реакції, якщо вихідні концентрації реагентів в першому випадку дорівнюють 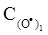 =
= 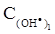 =1.0·10-4 моль/л, а в другому:
=1.0·10-4 моль/л, а в другому: 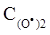 = 3.0·10-4 моль/л, С
= 3.0·10-4 моль/л, С 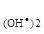 =2.0·10-4 моль/л.
=2.0·10-4 моль/л.
5. Реакція першого порядку проходять за 30 хв на 40%. Яка швидкість цієї реакції в моль/(л·хв) за концентрації реагуючої речовини 0.1 моль/л.
6. Константа швидкості реакції першого порядку за температури 298 К становить 5.8·10-5 хв-1. Визначить значення напівперіоду реакції та час 90% перетворення вихідної речовини.
7 За температури 300К час, за який реакція N2O5 = 2NO2 + 0.5O2 за початкової концентрації N2O5 С1=0.04 г/л проходить наполовину дорівнює τ1/2=8.2·103 с. Якщо початкова концентрація N2O5 дорівнює С2 = 0.02 г/л, напівперіод реакції становить τ1/2=8.7·103. Визначить порядок даної реакції.
8. Розрахуйте, скільки процентів вихідної речовини, що розкладається за першим порядком, прореагує за 30 хв, якщо константа швидкості реакції дорівнює 2.1·10-3 хв-1. Скільки часу потрібно для того, щоб прореагувало 90% речовини?
9. Константа швидкості реакції інверсії тростинного цукру за температури 300К становить 8.83·10-7 с-1. Визначить час напіврозпаду та час 90% перетворення цукру. Реакція проходить за першим порядком.
10. Для реакції А = В + С, що відбувається за першим порядком, визначте, скільки відсотків вихідної речовини прореагує за 30 хвилин та скільки часу потрібно для того, щоб прореагувало 90% речовини, якщо константа швидкості реакції становить 3.01·10-4 хв-1.
11. Обчисліть середнє значення константи швидкості реакції розкладу ацетону СН3СОСН3(г) = С2Н4(г) + СО(г) + Н2(г), знаючи зміну загального тиску з часом в ході реакції:
| τ, хв. | 6,5 | 13.0 | 19.9 | |
| Р·103, Па | 41.6 | 54.5 | 63.7 | 74.2 |
12.Визначить константу швидкості і порядок реакції розкладу оксиду етилену
(С2Н4)2О = СН4(г) + СО(г
за температури 690 К, якщо відома зміна загального тиску з часом:
| τ·10-3, с | 4.0 | 7.0 | 9.0 | 12.0 | 18.0 | |
| Р, кПа | 15.5 | 16.3 | 16.8 | 17.2 | 17.8 | 18.8 |
13. Кінетику розкладу гідразину у газоподібному стані вивчали вимірюванням парціального тиску азоту, що утворюється за реакцією:
3N2H4(г) = 4NH3(г) + N2(г)
За температури 700С незалежно від початкового тиску гідразину були одержані наступні результати:
| τ, хв | 4.0 | 7.0 | 9.0 | 12.0 | 18.0 | |
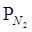 10-3, кПа 10-3, кПа
| 15.5 | 16.3 | 16.8 | 17.2 | 17.8 | 18.8 |
Визначить порядок реакції і константу швидкості реакції за температури 700С.
14. Бімолекулярна реакція між речовинами, що мають однакову концентрацію, за 20 хвилин пройшла на 25%. За який час ця реакція пройде на 50% за тієї ж температури?
15. Константа швидкості бімолекулярної реакції А + В = С дорівнює 6.1 л/(хв·моль). Розрахуйте кількість речовини "А", що прореагує за 10 хвилин; 1) якщо вихідні концентрації речовин однакові і дорівнюють СА = СВ = 0.04 моль/л; 2) якщо СА = 0.04 моль/л а СВ = 0.02 моль/л.
16. Реакція НСНО + Н2О2 = НСООН + Н2О є реакцією другого порядку. Якщо концентрації вихідних речовин однакові і дорівнюють 1 моль/л, то за температури 333 К через 120 хвилин концентрація мурашиної кислоти становить 0.22 моль/л. Розрахуйте константу швидкості реакції, час, за який реакція проходить на 90% і напівперіод реакції.
17. Для реакції А + В = D за СА = 1·10-3 моль/л і СВ=2·10-3 моль/л за 50 хв. концентрація речовини А стала рівною СА=0.5·10-3моль/л. Визначить константу швидкості реакції.
18. Речовини А і В змішані в рівних співвідношеннях (Со=2 моль/л). Через 300с залишилось 50% речовин А і В. Скільки речовини А залишиться через 1000с, якщо реакція відбувається за другим порядком?
19.Послідовна реакція першого порядку проходить за схемою:
А ¾k1® В ¾k2® С
За температури 298 К k1 = 0.1 год-1, k2 = 0.05 год-1. Початкова концентрація речовини "А" дорівнює 1 моль/л. Розрахуйте час досягнення концентрації [A]=0.001 моль/л.
20. Константи швидкостей першої і другої стадії послідовної реакції першого порядку відповідно дорівнюють k1 = 0.6 хв-1, k2 = 0.3 хв-1. Розрахуйте максимальну концентрацію проміжної речовини, якщо початкова концентрація вихідної речовини дорівнює 2 моль/л.
21.Початкова концентрація вихідної речовини послідовної реакції першого порядку дорівнює 1 моль/л. Константи швидкостей першої і другої стадій реакції відповідно дорівнюють: k1 = 0.3 с-1, k2 = 0.15 с-1. Розрахуйте час досягнення максимальної концентрації проміжної речовини і значення її максимальної концентрації.
22. Для послідовної реакції першого порядку А ¾k1® В ¾k2® С розрахуйте точку перетину кривих [A] = f(τ) i [B] = f(τ), якщо початкова концентрація вихідної речовини [A]0 = 1.5 моль/л, а константи швидкостей реакції дорівнюють k1 = 0.5 хв-1, k2 = 0.25 хв-1
23.У скільки разів зросте швидкість реакції при підвищенні температури від 298К до 338K, якщо енергія активації реакції дорівнює 115 кДж?
24. Час напіврозпаду речовини, що розкладається за першим порядком, за температури 323К становить 100 хвилин, а за температури 353 К – 15 хвилин. Розрахуйте температурний коефіцієнт цієї реакції.
25. Експериментально визначені константи швидкості реакції взаємодії метану з водяною парою мають значення:
| Т,К | 574.5 | 497.2 | 483.2 |
| k, л/(моль·с) | 8.56·10-2 | 3.6·10-4 | 1.206·10-4 |
Визначить енергію активації реакції.
26. Органічна кислота розкладається у водному розчині за першим порядком. Розклад вивчався за різних температур і одержані наступні значення констант швидкостей:
| Т,К | 273.2 | 293.2 | 313.2 | 333.2 |
| k·105, хв-1 | 2.46 | 47.5 |
Скористайтесь графічною залежністю lnk = f(1/T) для визначення енергії активації реакції. Обчисліть передекспонентний множник k0 рівняння Арреніуса і напівперіод для цієї реакції за температури 323К.
27. Речовина розкладається за першим порядком. Енергія активації розкладу становить 230 кДж/моль. За 1 годину за температури 300 К речовина розкладається на 60%. Розрахуйте температуру, за якої речовина за 1 годину розкладеться на 90%.
28. Гідроліз солі діазонію відбувається за першим порядком. За температури 298 К константа швидкості гідролізу становить 9·10-3 хв-1, а за температури 303 К константа швидкості дорівнює 13·10-3 хв-1. Обчисліть константу швидкості реакції за температури 308 К.
29. Константи швидкості реакції другого порядку за температур 298 К і 328 К дорівнюють 1·10-3 і ·10-2 л/(моль·хв) відповідно. Розрахуйте швидкість цієї реакції за температури 310 К у початковий момент реакції, якщо початкові концентрації вихідних речовин однакові і дорівнюють 0.2 моль/л.
30. Необоротна реакція другого порядку А + В = С проходить за 200 хвилин на 90% за температури 300К коли початкові концентрації речовин однакові і дорівнюють 0.1 моль/л. А за температури 320 К проходить протягом 40 хвилин. Обчисліть час, коли реакція пройде на 99% за температури 310К і початковій концентрації вихідних речовин 0.2 моль/л.
31. Реакція ізомеризації ізопропілового етеру у алілацетон відбувається за першим порядком. Залежність константи швидкості від температури описується рівнянням 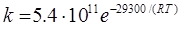 . За який час за температури 420К парціальний тиск алілацетону буде становити 300 мм Hg, якщо початковий тиск ізопропілового етеру становить 760 мм Hg?
. За який час за температури 420К парціальний тиск алілацетону буде становити 300 мм Hg, якщо початковий тиск ізопропілового етеру становить 760 мм Hg?
32..Реакція 1-го порядку проходить на 25% за температури 300 К за 25 хв., а за температури 320 К за 6 хв. Розрахуйте енергію активації реакції.
33. Розрахуйте передекспонентний множник в рівнянні Арреніуса, якщо за 303К константа швидкості дорівнює 8.01 год-1 , а за 403 К – 39.87 год-1.
34. Реакція термічного розкладу етану за Т=803К має константу швидкості 4.5·105 (с-1), а за 893 К 243.5·105 (с-1). Чому дорівнює константа швидкості цієї реакції за 860 К? Який порядок цієї реакції?
35. Залежність константи швидкості реакції від температури має вигляд:
lgk = -18953/T + 2lgT + 12.130
Розрахуйте енергію активації цієї реакції за температури 800К.
36. Константи швидкості реакції за 300 і 330 К відповідно дорівнюють 9.8 і 81.3 хв-1. Визначить порядок, енергію активації і температурний коефіцієнт швидкості реакції.
37. Дві реакції одного порядку мають однакові значення передекспонентний множника, але їх енергії активації розрізняються на 42 кДж/моль. Розрахуйте співвідношення констант за температури 500 К.
38. Необоротна реакція другого порядку А + В = С за рівних концентрацій вихідних реагентів ( [A]0 = [B]0 = 0.1 моль/л) за температури 300 К проходить на 90% протягом 200 хвилин. За температури 320 К і тих же концентраціях вихідних реагентів 90% перетворення спостерігалось за 40 хвилин. Розрахуйте час, за який реакція пройде на 99% за температури 330 К і вихідних концентраціях реагентів [A]0 = [B]0 = 0.01 моль/л.
39. Для оборотної реакції розкладу НІ за температури 667 К константа швидкості прямої реакції k1 = 0.26 см3/(моль·), а зворотної – k-1=15.60 см3/(моль·). За температури 699 К ці значення становлять відповідно k1 = 1.24 см3/(моль·) і k-1= 67.00 см3/(моль·). По наведених даних визначте:
а) температурну залежність константи швидкості прямої і зворотної реакцій;
б) температурну залежність константи рівноваги дисоціації НІ;
в) константу рівноваги за температури 550 К.
40. При фотохімічному утворенні фосгену реакція проходіть за таким механізмом:
Сl2 + h 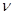 ¾k1® 2Cl·
¾k1® 2Cl·
CO + Cl· ¾k2® COCl·
COCl·+ Сl2 ¾k3® COCl2 + Cl·
COCl· +Cl· ¾k4® CO + Сl2
Запишіть рівняння константи швидкості утворення фосгену.
41. Термічний розклад озону відбувається за схемою:
О3 ¾k1® О2 + О·
О2 + О· ¾k2® О3
О·+ О3¾k3® 2О2
За допомогою методу стаціонарних концентрацій запишіть вираз для швидкості реакції.
42. Для термічного розкладу кристалічного перхлорату амонію був запропонований наступний механізм:
ClО4¯ ¾k1® ClО4· + e
ClО4· + e ¾k2® ClО4¯
ClО4·¾k3® ClО2 +О2
Користуючись методом стаціонарних концентрацій, виведіть рівняння для швидкості реакції 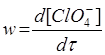 . (Рахувати ClО4¯ стабільною частинкою).
. (Рахувати ClО4¯ стабільною частинкою).
43. Розклад газоподібного сілану відбувається за наступним механізмом:
SiН4 ¾k1®SiH2· + H2·
SiH2· ¾k2® Si + H2¯
SiH2· + H2¾k3® SiН4
Використовуючи метод стаціонарних концентрацій, виведіть рівняння швидкості розкладу SiН4.
44. Розрахуйте загальне число зіткнень за 1с в 1см3 між молекулами азоту за температури 298 К і тиску 1.01·105 Па. Діаметр молекули азоту становить 3.22 nm.
45. Енергія активації бімолекулярної реакції термічного розкладу ацетальдегіду становить 1911 кДж/моль. Розрахуйте число молекул, що прореагують в 1·10-3 м3 за 1 с за температури 700 К і тиску 1.013·105 Па, якщо діаметр молекули ацетальдегіду дорівнює σ1,2 = 5.1·10-8 см
46.Для мономолекулярної реакції розкладу ацетону енергія активації дорівнює Е = 286600 Дж/моль. Діаметр молекули ацетону становить 4.9·10-10м. Розрахуйте константу швидкості реакції за температури 800 К і тиску 1.013·105 Па.
47. Дослідне значення константи швидкості реакції СН3ОСН3 = СН4+Н2+СО дорівнює 0.54·10-3 с-1. Розрахуйте енергію активації реакції, приймаючи до уваги, що стеричний фактор дорівнює 4.3·104, діаметр молекули етеру становить 4.5·10-10 м, тиск в системі 0.731·105 Па.
48.Розрахуйте значення стеричного фактору в реакції димеризації етилену 2С2Н4 = С4Н8 за температури 300 К, якщо дослідна енергія активації становить 146.4 кДж/моль, а константа швидкості реакції дорівнює 1.08·10-14 см3/(моль·с).
49.Дослідна константа швидкості реакції С2Н4 + Н2 = С2Н6 за температури 787К дорівнює 1.77·10-2 л/(моль·с). Середній діаметр молекули етилену становить 2.0·10-10 м, молекули водню 1·10-10 м. Стеричний множник дорівнює 0.05. Розрахуйте істинну енергію активації реакції.
50.Дві реакції однакового порядку мають рівні енергії активації, але їх ентропії активації відрізняються на 45 Дж/(моль·К). Розрахуйте співвідношення констант швидкостей реакції.
51.Для реакції С2Н5І + С5Н5N = С7Н10NІ за температури 300 К константа швидкості дорівнює k = 1.70·10-6 л/(моль·с), ентропія активації становить 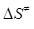 = - 119.0 Дж/(моль·К). Розрахуйте енергію активації (Е) і зміну ентальпії активації реакції (
= - 119.0 Дж/(моль·К). Розрахуйте енергію активації (Е) і зміну ентальпії активації реакції ( 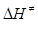 ).
).
52. Константа швидкості гідролізу сульфамідної кислоти за температури 363 Кдорівнює k = 1.16·10-3 л/( моль·с ), енергія активації реакції Е=127490 Дж/моль. Розрахуйте зміну ентальпії ( 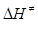 ), ентропії (
), ентропії ( 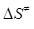 ) і енергії Гіббса (
) і енергії Гіббса ( 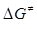 ) при утворенні активованого комплексу.
) при утворенні активованого комплексу.
53.Розклад перекису ди-трет-бутилу у газовій фазі являє собою реакцію першого порядку, температурна залежність константи швидкості якої (с-1) має вигляд: k = 32·1016ехр(-4700/Т). Розрахуйте зміну ентальпії і ентропії при утворенні активного комплексу за температури 2000С.
54.Температурна залежність константи швидкості мономолекулярної реакції має вигляд: k = 5.4·1011ехр(-35200/Т). Розрахуйте зміну ентальпії і ентропії при утворенні активного комплексу за температури 4000С.
55.Залежність константи швидкості розкладу винилетилового етеру
С2Н5ОСН=СН2 = С2Н4 + СН3СНО
від температури має вигляд: k = 2.7·1011ехр(-10200/Т) (с-1). Розрахуйте зміну ентропії при утворенні активного комплексу за температури 5300С.
56.В газовій фазі речовина розкладається за механізмом реакції першого порядку. Константи швидкості за температур 120 і 1400С дорівнюють, відповідно: 1.806·10-4 і 9.14·10-4 с-1. Розрахуйте середні зміни ентальпії і ентропії при утворенні активного комплексу у цьому температурному інтервалі.
57.Константа швидкості реакції першого порядку розкладу брометану за температури 5000С дорівнює 7.3·1010 с-1. Розрахуйте зміну ентропії при утворенні активного комплексу, якщо енергія активації реакції дорівнює 55 кДж/моль.
58.Константа швидкості бімолекулярної реакції за температури 1600К дорівнює k1 = 0.011 л/(моль·с),, а за температури 1500 К – k2=0.003 л/(моль·с). Розрахуйте 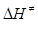 і
і 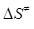 за температури 1550К.
за температури 1550К.
59.Передекспонентний множник константи швидкості реакції дисоціації циклопентадієну в газовій фазі дорівнює 1.3·1013 с-1, енергія активації Е = 146300 Дж. Розрахуйте константу швидкості реакції за температури Т = 373 К і зміну ентропії при утворенні активного комплексу ( 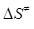 ).
).
60.При опромінюванні джерелом світла з довжиною хвилі λ = 400 nm було одержано по реакції СО + СІ2 = СОСІ2 100 г фосгену. Реакційна суміш при цьому поглинула E = 300 Дж променевої енергії. Розрахуйте квантовий вихід.
61.При опромінюванні кисню світлом з довжиною хвилі λ = 207 nm утворюється озон за реакцією 3О2 = 2О3. Квантовий вихід становить γ = 3. Яка кількість світлової енергії потрібна для утворення 1 моля озону?
62.Розрахуйте енергію світла, що поглинається при протіканні фотохімічної реакції С6Н12 + Br2 = С6Н11 Br + НBr, якщо за час опромінювання світлом з довжиною хвилі λ = 470 nm прореагував 1 моль Br2. Квантовий вихід дорівнює γ = 1.
63.НІ у газоподібному стані опромінювали світлом з довжиною хвилі λ=207nm. За час опромінювання реакційне середовище поглинуло 1 Дж світлової енергії. При цьому продисоціювало 4.4·10-4 г НІ. Розрахуйте квантовий вихід реакції.
| <== попередня сторінка | | | наступна сторінка ==> |
| Результати розрахунку квантового виходу реакції | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |