
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Поняття про хімічний потенціал
Питання
ЛЕКЦІЯ 5 ХІМІЧНА РІВНОВАГА
5.1 Поняття про хімічний потенціал
5.2 Константа хімічної рівноваги. Рівняння ізотерми хімічної
реакції
5.3 Вплив зовнішніх умов на хімічну рівновагу
5.4 Хімічна рівновага у гетерогенних системах
На основі взаємозв¢язку між термодинамічними потенціалами і параметрами системи припускалося, що маса системи незмінна. Тоді для визначення стану системи достатньо було задати дві незалежні змінні величини (наприклад, Р і Т, V і S тощо). У хімічних реакціях склад системи змінюється, часто речовина переходить з одного агрегатного стану в інший. У цьому випадку до незалежних змінних як складова входить ще й склад суміші.
Термодинамічні потенціали кожної частини такої системи можуть бути подані функцією двох змінних та кількості молів усіх речовин, що входять до системи. Наприклад:
U = f(S,V,n1,n2…nk), G = f(P,T,n1,n2…nk). (5.1)
Повний диференціал енергії Гіббса можна записати цьому випадку так:
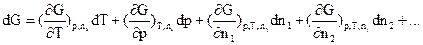
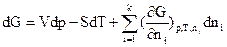 (5.2)
(5.2)
Частинна похідна енергії Гіббса за кількістю молів будь-якого (i) компонента при незмінній кількості молів усіх іншіх компонентів (j) та при Р,Т = const називається хімічним потенціалом даного компонента
 (5.3)
(5.3)
З урахуванням цього співвідношення вираз для повного диференціала енергії Гіббса набуде вигляду
k
dG = VdP – SdT + å midni. (5.4)
i=1
Якщо реакція проходить при постійних Р і Т, то
k
dG = å midni. (5.5)
i=1
Після інтегрування отримуємо
DG = å miDni
i
і Gi = mini, (5.6)
тобто хімічний потенціал чистої речовини дорівнює енергії Гіббса одного моля цієї речовини.
За умови рівноваги dG = 0 і з (5.5) отримуємо
å mi dni = 0. (5.7)
і
Це рівняння називається рівнянням Гіббса-Дюгемаі єзагальною умовою рівноваги у системі зі змінною кількістю компонентів при постійних температурі та тиску.
Аналогічні міркування можна провести не тільки для енергії Гіббса, але й для внутрішньої енергії, ентальпії та енергії Гельмгольца. У цих випадках можна записати
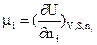 =
=
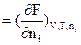 (5.8)
(5.8)
Таким чином, хімічний потенціал може бути виражений через частинну похідну будь-якого термодинамічного потенціалу за числом молей компонента, кількість якого змінюється при постійних значеннях відповідних незалежних змінних і числі молей всіх інших компонентів.
Дуже часто хімічний потенціал подають у вигляді
m = m0(T) + R×T×lnP, (5.9)
де m0(Т) – стандартний хімічний потенціал ідеального газу.
Хімічний потенціал можна також виразити через концентрації:
m = m10(T) + R×T×lnс. (5.10)
Сталі m0 та m10 поєднані між собою співвідношенням
m10(Т) = m0(T) + R×T×lnRT. (5.11)
Читайте також:
- II. Поняття соціального процесу.
- IV. Критерій питомої потенціальної енергії деформації формозміни
- V. Поняття та ознаки (характеристики) злочинності
- А/. Поняття про судовий процес.
- Адміністративний проступок: поняття, ознаки, види.
- Адміністративні провадження: поняття, класифікація, стадії
- Акти застосування юридичних норм: поняття, ознаки, види.
- Алгоритм формування потенціалу Ф2
- Аналіз ступеня вільності механізму. Наведемо визначення механізму, враховуючи нові поняття.
- Аналіз трудового потенціалу
- АРХІВНЕ ОПИСУВАННЯ: ПОНЯТТЯ, ВИДИ, ПРИНЦИПИ І МЕТОДИ
- Атмосфера. ЇЇ хімічний склад та будова
| <== попередня сторінка | | | наступна сторінка ==> |
| Соціально-психологічні методи управління | | | Константа хімічної рівноваги. Рівняння ізотерми хімічної реакції |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |