
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Дисоціація електролітів
Розпад молекул електролітів на йони під дією розчинника називається електролітичною дисоціацією або йонізацією.
Кількісною характеристикою здатності електролітів розпадатися на йони є ступінь електролітичної дисоціації (йонізації) α, який показує, яка частина молекул розчиненої речовини розпалася на йони:
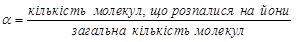 . (3.2)
. (3.2)
Величину α виражають в частках (вiд 0 до 1) або у % (вiд 0 до 100%).
За здатністю речовин до дисоцiацiї всі електролiти поділяються на три групи:
1) сильні (α > 30 %): HCl, HBr, HNO3, H2SO4, NaOH, KOH, Ba(OH)2, майже всi розчиннi у водi солi;
2) середньої сили (α = 5–30 %): H3AsO4, H3PO4, H2SO3, H2C2O4 та iншi;
3) слабкі (α < 5 %): H2CO3, HBO2, HCN, H2S, NH4OH, HgCl2, CdCl2 та iншi.
Закон дії мас застосовують до реакцій дисоціації слабких електролітів, реакцій утворення осадів та комплексних сполук, до процесів гідролізу солей. Для сильних електролітів закон дії мас виконується точно, якщо замість концентрації реагентів використовувати активність (а)- ефективну, уявну концентрацію речовини, відповідно до якої вона діє у реакції:
a = γ∙C, (3.3)
де С -концентрація речовини моль/дм3; γ - коефіцієнт активності, безрозмірна величина, що є мірою впливу різних чинників на концентрацію.
Значення коефіцієнту активності залежить не тільки від концентрації електроліту в розчині, але і від присутності в ньому інших електролітів. Вплив всіх йонів, присутніх у розчині, враховує йонна сила розчину μ:
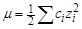 , (3.4)
, (3.4)
де сi - концентрація кожного йону в розчині; zi - заряд даного йону.
Коефіцієнт активності пов’язаний з йонною силою розчину співвідношенням
- 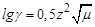 . (3.5)
. (3.5)
Значення коефіцієнта активності знижується із зростанням йонної сили розчину, тобто залежить від присутності в розчині сторонніх електролітів.
Переглядів: 241