
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Йонізація води. Водневий та гідроксильний показники
Більшість аналітичних реакцій відбуваються у водних розчинах. Вода є слабким електролітом і незначно йонізується:
H2O↔H+ + OH-.
За 25 °С в 1 дм3 води розпадаються на йони лише 10–7 моль.
Під час йонізації з кожної молекули утворюється по одному йону H+ i OH–, тобто [H+]=[OH–]=10-7 моль/дм3.
Константу рiвноваги для цiєї дисоцiацiї можна записати як:
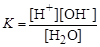 або
або 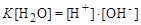 .
.
Оскільки вода, в основному, знаходиться у вигляді нейонізованих молекул, то значення [Н2О] можна вважати постійним. Тому ліва частина цього рівняння, а, відповідно, і добуток [H+][ОН-] є величиною постійною. Її називають йонним добутком води і позначають КW:
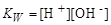 . (3.6)
. (3.6)
Оскільки за 25 °С у чистій воді [H+]=[OH–]=10-7 моль/дм3, то КW=10-7∙10-7=10-14. Підвищення температури приводить до збільшення значення КW.
Суть цього рівняння: як би не змінювалася концентрація водневих чи гідроксильних йонів, їх добуток у водному розчині є величиною постійною і за 25 °С має значення 10-14. Додавання до чистої води кислоти приведе до збільшення концентрації водневих йонів і вона буде більшою, ніж 10-7, але одночасно зменшиться концентрація гідроксильних йонів у стільки ж разів і буде меншою, ніж 10-7. Тобто в розчині кислоти [H+] > 10-7.
Під час додавання основи спостерігатиметься зворотний процес - збільшується концентрація гідроксильних йонів та зменшується водневих:[OH–] > 10-7.
У нейтральних розчинах [H+]=[OH–]=10-7. У практиці замість значень концентрацій зручніше користуватись від’ємним логарифмом цих величин.
Кислотність розчинів характеризує водневий показник або рН:
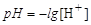 . (3.7)
. (3.7)
Основність розчинів характеризує гідроксильний показник або рОН:
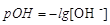 . (3.8)
. (3.8)
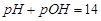 . (3.9)
. (3.9)
Знаючи концентрацію гідроксильних йонів, рН або рОН, можна розрахувати вміст водневих йонів в розчині:
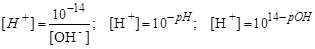 .
.
Розрахунок рН розчинів сильних кислот та основ
У водних розчинах сильні кислоти повністю йонізовані, тому концентрація водневих йонів і рН їх розчинів визначається концентрацією кислоти:
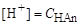 ,
, 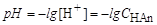 .
.
Аналогічно для сильної основи
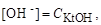
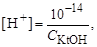
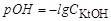 ,
, 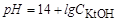 .
.
Переглядів: 1936