
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Окисно-відновні потенціали
Роздiлення окисно-вiдновної реакцiї на двi пiвреакцiї – не лише формальний спосіб, що полегшує тлумачення процесу передачi електронiв або пiдбiр стехiометричних коефiцiєнтiв, воно має цiлком визначений фiзичний змiст. Розчиненi компоненти кожної напiвреакцiї (II) можна помiстити в рiзнi посудини (рис. 6.1) та з'єднати їх солевим містком (розчин KCl). Якщо в кожну посудину занурити інертнi (нерозчиннi) електроди, наприклад, вугiльнi або платиновi, i замкнути коло на гальванометр (Г), то прилад покаже наявнiсть струму. В посудинах на поверхнi електродiв почнуться реакцiї передачi електронiв: вiд відновника (наприклад, Fe2+) до електроду i вiд електроду до окисника (наприклад, Ce4+), що викличе потiк електронiв у зовнiшньому колi (через гальванометр) та через солевий мiсток. Пристрiй зображений на рис. 6.1 називають гальванічним елементом, а кожну з посудин, що мiстить розчин із зануреним електродом, – півелементом.
Внаслiдок протiкання реакцiї в гальванiчному елементi хімiчна енергiя перетворюється в електричну. Електрорушiйну силу (ЕРС) гальванiчного елемента вимiрюють компенсаційним методом за допомогою потецiометра, де вимiрювана ЕРС врівноважується відомою різницею потенціалів, що створюється допоміжним джерелом струму. Тоді при вимiрах в колi елемента протiкає дуже малий струм, тобто І ® 0.
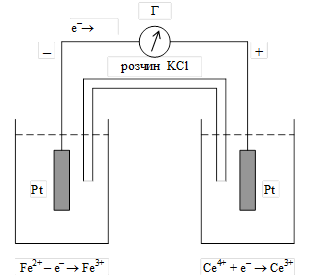
| ЕРС гальванічного елемента безпосередньо характеризує здатнiсть електронiв вiдновника, наприклад, Fe2+ переходити до даного окисника (Ce4+) i є рiзницею: ΔE = joк – jвідн, (6.1) де ΔE – ЕРС гальванічного елемента, В; joк – потенцiал окисника, В; jвідн – потенцiал вiдновника, В. Кожен пiвелемент складається з окисненої та відновленої форм даної речовини, яку називають окисно-відновною, або редокс-парою, наприклад, Fe3+/Fe2+. |
| Рис. 6.1 Схема гальванічного елемента |
Потенціал окисно-відновної пари позначають як j(Fe3+/Fe2+), а стандартні електродні потенціали позначують верхнiм iндексом (о), наприклад, jo(Fe3+/Fe2+).
Потенцiал електрода встановлюється по вiдношенню до розчину, а тому вимiряти абсолютне значення потенцiалу окремої редокс-пари є неможливо. Однак, можна вимiряти різницю потенціалів ΔE двох електродiв у гальванiчному елементi. Якщо кожен електрод комбiнувати з одним i тим же електродом, умовно вибраним за стандартний, то одержимо вiдноснi окисно-вiдновнi потенцiали пар.
У ролі стандартного вибраний водневий електрод (рис. 6.2). Це електрод з платинованої пластини, який насичується газоподiбним воднем при стандартних умовах і занурений в розчин кислоти. Пластина, покрита черненою платиною, насичується воднем i дiє так, ніби електрод складається з газоподiбного водню, що знаходиться в рiвновазi з йонами H+ в розчинi:
H2(г) « 2H+ + 2e–. (VI)
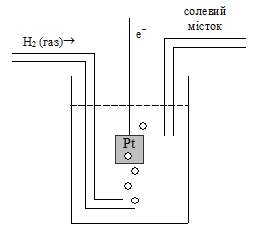
| Потенцiал стандартного водневого електрода φo(2H+/H2) умовно приймають рівним нулю при будь-якій температурі. Таким чином, потенцiал електрода, що знаходиться в парi з водневим, – це напруга гальванiчного елемента, складеного з даного та стандартного водневого електродів, наприклад: ΔЕ = j (Fe3+/Fe2+) – j (2H+/H2), а при jo(2H+/H2) = 0 ΔЕ = jo(Fe3+/Fe2+). (6.2) |
| Рис. 6.2. Схема водневого електрода |
Потенцiал окисно-вiдновної системи вважають додатним, коли система виступає окисником по вiдношенню до стандартного водневого електрода, або від’ємним, коли система виступає вiдновником по вiдношенню до цього електрода.
Окисником в окисно-вiдновнiй реакцiї при стандартних умовах може бути лише та окиснена форма, стандартний потенцiал якої бiльший, нiж в окисненої форми вiдновника. Наприклад, MnO4– + 8H+ буде окиснювати йони Cl– до Cl2, однак Cl2 не зможе окиснювати Mn2+ до MnO4–, так як
jo(MnO4–/Mn2+) = 1.51 > 1.359 = jo(Cl2/2Cl–).
В результатi протiкання реакцiй зменшується вільна енергія системи (енергія Гіббса G). У гальванiчному елементi при стандартних умовах зменшення вiльної енергiї ΔG рiвне роботi по перенесенню заряду в електричному полi, тобто
–ΔG = nFΔjo, (6.3)
де n – число електронiв, що приймають участь в процесi; F = 96485 Кл/моль – число Фарадея.
Якщо ж одним з електродiв служить стандартний водневий електрод, то
Δj (Ок/Відн) = jo(Ок/Відн) – jo (2H+/H2) = jo(Ок/Відн)
i, вiдповiдно,
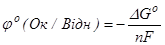 . (6.4)
. (6.4)
Переглядів: 332