
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Номенклатура альдегідів і кетонів
Систематичні назви альдегідів складають за назвою відповідного вуглеводню з додаванням суфікса -аль. Нумерацію ланцюга починають з карбонільного атома Карбону.Тривіальні назви складають від тривіальних назв тих кислот, на які альдегіди перетворюються в результаті окиснення. Систематичні назви кетонів нескладної будови утворюють від назв радикалів (у порядку збільшення) з додаванням слова «кетон» (радикально-функціональна). Наприклад:CH3 - CO - CH3 — диметилкетон (ацетон);CH3CH2CH2 - CO - CH3 — метилпропілкетон.
У більш загальному випадку назва кетону складається за назвою відповідного вуглеводню й суфікса -он; нумерацію ланцюга починають з кінця ланцюга, що знаходиться найближче до карбонільної групи (замісна номенклатура IUPAC). Наприклад:CH3 - CO - CH3 — пропанон (ацетон); CH3CH2CH2 - CO - CH3 — 2-пентанон; CH2 = CH - CH2 - CO - CH3 — 4-пентен-2-он.
Атоми Карбону й Оксигену в карбонільній групі перебувають у стані sp2-гібридизації. У молекулах альдегідів і кетонів відсутні атоми Гідрогену, здатні до утворення водневих зв’язків, тому температури кипіння цих речовин нижчі, ніж у відповідних спиртів. Метаналь (формальдегід) — газ, альдегіди С2 — С5 і кетони С3 — С4 — рідини, вищі — тверді речовини. Нижчі гомологи розчинні у воді завдяки утворенню водневих зв’язків між атомами Гідрогену молекул води й карбонільних атомів Оксигену. Зі збільшенням вуглеводневого радикала розчинність у воді знижується.
13) Карбо́нові кисло́ти – органічні сполуки, що містять одну або декілька карбоксильних груп COOH. За кількістю цих груп розрізняють одноосновні (бензойна, оцтова кислота), двоосновні (щавелева, малонова, фталева, азелаїнова кислота) та багатоосновні (лимонна кислота).Класифікація за вмістом Оксигену: оскільки до складу функціональної групи кислот входять атоми Оксигену, то всі карбонові кислоти належать до оксигеновмісних кислот.Класифікація за силою кислот: усі карбонові кислоти є слабкими кислотами. Причому зі збільшенням вуглеводневого радикала сила кислот зменшується. Фактично найсильнішою карбоновою кислотою є трифтороцтова (СF3СООН), що є кислотою середньої сили (рКа = 0,23).Класифікація за основністю кислот: так само, як неорганічні кислоти, органічні поділяють за основністю. Причому основність кислот визначається кількістю карбоксильних груп. Винятком є найпростіша двохосновна карбонова кислота — карбонатна. Класифікація за вуглеводневим радикалом: карбонові кислоти можна класифікувати за вуглеводневим радикалом — насичені, ненасичені (акрилова) та ароматичні (бензойна, фталева, корична, саліцилова).
14) Монокарбонові (одноосновні):НСООН мурашина (метанова) кислота,СН3СООН оцтова (ацетатна, етанова) кислота. Мураши́на кислота́(метанова кислота), H-COOH — безбарвна рідина з різким запахом, кипить при 101 ˚С. Розчиняється у воді в будь-яких пропорціях. Викликає опіки на шкірі. Міститься у виділеннях залоз мурашок, а також у деяких рослинах (у листі кропиви). Мурашина кислота — єдина із карбонових кислот, у молекулі якої міститься альдегідна група -СНО. Тому вона, як і альдегіди, окиснюється перманганатом калію, оксидом аргентуму(I) у розчині аміаку (тобто дає реакцію «срібного дзеркала»). При нагріванні з концентрованою сульфатною кислотою мурашина кислота розкладається на оксид карбону(ІІ) і воду. О́цтова кислота́ — органічна сполука, одноосновна карбонова кислота складу CH3COOH. За звичайних умов є безбарвною рідиною із різким запахом. Температура плавлення чистої кислоти дещо нижча від кімнатної температури, при замерзанні вона перетворюється на безбарвні кристали — це дало їй технічне найменування льодяна оцтова кислота. Взаємодіючи з металами, лугами та спиртами, оцтова кислота утворює ряд солей та естерів — ацетатів (етаноатів).Оцтова кислота — один з базових продуктів промислового органічного синтезу. Більш ніж 65% світового виробництва оцтової кислоти йде на виготовлення полімерів, похідних целюлози та вінілацетату. Полівінілацетат є основою багатьох ґрунтівних покрить та фарб. З ацетатної целюлози виготовляють ацетатне волокно. Оцтова кислота та її естери важливі промислові розчинники та екстрагенти.Оцтова кислота є типовою карбоновою кислотою, вона бере участь у всіх реакціях, притаманних для цього ряду сполук.У водному розчині кислота дисоціює та віддає іон H+ молекулам води, утворюючи структуру із двома рівними зв'язками C—O, При нагріванні до 600 °C оцтова кислота дегідратується до кетену — етенону.
15. Дикарбонові кислоти мають загальну формулу C n H 2 n (COOH) 2. З них найважливішими є:
-СООН - щавлева, етандікарбоновая кислота;
-СН 2-СООН - малонова, пропандікарбоновая кислота;
-СН 2-СН 2-СООН - янтарна, бутандікарбоновая кислота;
-СН 2-СН 2-СН 2-СООН - глутарова, пентандікарбоновая кислота.
Ароматичні кислоти: це вуглеводні (бензол, нафталін, антрацен і ін.) і їхні похідні (анілін, бензойна кислота, фенол і ін.), які містять у молекулі цикли (так звані бензольні ядра) з 6 атомів вуглецю. До ароматичних систем відносять також так звані небензоїдні сполуки — фуран, тіофен, піридин (C6H5N) і ін.
16. Нейтральні ліпіди — це похідні вищих жирних кислот і трьохатомного спирту гліцерину. Як і вуглеводи, жири використовуються як джерело енергії: під час розщеплення одного грама жиру виділяється 38,9 кДж енергії. Підшкірний жир виконує важливу теплоізоляційну функцію, а також сприяє зменшенню впливу ударів та поштовхів. Для тварин, які впадають у сплячку, жири забезпечують організм необхідною енергією, оскільки поживні речовини ззовні в цей час не надходять. Жири становлять запас поживних речовин і в насінні багатьох рослин.
Фосфоліпіди — найбільша частина ліпідів, які входять до складу клітинних мембран. Якщо в середньому на ліпіди припадає 40 % сухої маси мембран, то 80 % з них — на фосфоліпіди. Отже, основні функції мембран (регулювання проникності різних речовин і клітинного вмісту, функціонування іонних насосів, сприйняття, оброблення і передавання всередину клітини інформації з її поверхні, імунна відповідь, синтез білків і багато іншого) здійснюються за участю фосфоліпідів.
Ліпіди не розчинні у воді і добре розчинні в органічних розчинниках (бензині, ефірі тощо). Самі ліпіди є розчинниками для деяких вітамінів. Ліпіди займають у клітині 5–15% сухої речовини. Ліпіди — це похідні вищих жирних кислот і багатоатомних спиртів або альдегідів.
17. Омилювані ліпіди утворюють в лужному середовищі (рН>7) солі вищих жирних кислот.
ПРОСТІ ліпіди – це складні ефіри вищих жирних кислот і спиртів (гліцерину), які під час гідролізу (кислотного або ферментативного) утворюють спирт і вищі жирні кислоти (С16-С24).
Насичені жирні кислоти входять до складу твердих (тваринних) жирів (баранячий, яловичий):
C17H35COOH (C18:0) - стеаринова кислота:
С15H31COOH (C16:0) - пальмітинова кислота
Ненасичені жирні кислотивходять до складу рідких (рослинних) жирів, які називають оліями, наприклад: оливкова, соєва, арахісова, соняшникова тощо.C17H33COOH – олеїнова кислота,,C18:1CH3-(CH2)7-CH=CH-(CH2)7-COOH,C17H31COOH – лінолева кислота,C18:2 CH3-(CH2)4-(CH=CH-CH2)2-(CH2)6-COOH,C19H30COOH – арахідонова кислота,C20:4 CH3-(CH2)4-(CH=CH-CH2)4-(CH2)2-COOH. У природних жирах залишки кислот містять у молекулі парне число атомів Карбону (від 12 до 20) і нерозгалужений ланцюг. Найчастіше зустрічаються кислоти з 16 і 18 атомами вуглецю в молекулі. Такі кислоти утворюють тверді жири.
18. Фосфоліпіди — полярні гліцероліпіди, в яких дві гідроксильні групи гліцеролу заміщені вищими жирними кислотами, а третя зв’язана із залишком ортофосфатної кислоти (вільної чи етерифікованої холіном, етаноламіном або міоінозитом) або залишком сахаридів (глікозилдигліцериди). Їх поділяють на фосфогліцероли, фосфосфінголіпіди, фосфоноліпіди, діольні фосфоліпіди і амінокислотні ефіри фосфатидилгліцеролу (див. Фосфоліпіди). У тканинах живих організмів фосфоліпіди виконують такі функції: 1) структурні компоненти мембран; 2) активатори ензимів; 3) компоненти сурфактанту легенів; 4) джерела арахідонової кислоти (попередника ейкозаноїдів), месенджерів (діацилгліцеролу та інозитолтрифосфату); 5) беруть участь у формуванні транспортних форм інших Л.; 6) можуть виконувати енергетичну функцію.
19.АМІНОСПИРТИ (аміноалкоголі, алканоламіни, гідроксіаміни) — похідні вуглеводнів, молекула яких містить аміногрупу (N-алкіл- або N, N-діалкіламіногрупу) та спиртовий гідроксил.
Найбільше практичне значення мають етаноламіни. Моноетаноламін (2-аміноетанол, коламін) NH2–CH2–CH2–OH — в’язка гігроскопічна рідина, Tкип 171 °С, добре розчинна у воді, її водний розчин має сильнолужну реакцію і входить до складних ліпідів. Утворюється при розщепленні фосфатидів.
2-N,N-діетиламіноетанол (C2H5)2N–C2H4OH є напівпродуктом у виробництві новокаїну. Похідна моноетаноламіну — димедрол має протиалергічну (антигістамінну) та снотворну дію. Холін (2-гідроксіетилтриетиламонію гідроксид) [HO–CH2–CH2–N+(CH3)3]OH– — безбарвна кристалічна речовина.
У медичній практиці використовують ацетилхолін-хлорид та карбахолін як холіноміметичні (гіпотензивні, міотичні) препарати при атонії кишечнику та сечового міхура, при глаукомі, ранніх формах артеріальної гіпертонії тощо.
20. Гідроксикисло́ти, о́ксикисло́ти, — похідні карбонових кислот, в яких один або кілька атомів гідрогену заміщені на гідроксильні (спиртові) групи. Іноді їх називають спиртокислотами.
Кількість карбоксильних груп, що містяться в молекулі кислоти, визначає її основність. За кількістю гідроксилів, включаючи гідроксили карбоксильних груп, визначають атомність гідроксикислот. Залежно від кількості карбоксильних груп, що містяться в молекулах таких сполук, розрізняють одно-, двох- і триосновні гідроксикислоти. За кількістю гідроксильних груп, що містяться в молекулах цих сполук, розрізняють двох-, три- і багатоатомні гідроксикислоти. За місцем розміщення групи -ОН у радикалі розрізняють α-, β-, γ-, σ-гідроксикислоти.
21. Специфічною властивістю фенолокислот є їх здатність реагувати з галоген-ангідридами фенолокислот з утворенням сполук типу естерів — полідепсидів. При нагріванні фенолокислоти досить легко піддаються декарбоксилюванню. Синтезують Гідроксикислоти гідролізом галогенозаміщених кислот, гідратацією ненасичених кислот, діазотуванням амінокислот, відновленням кетокислот, окисненням гліколів, гідроксіальдегідів, гідролізом оксинітрилів, сплавленням з лугами аренсульфокислот, окисненням гомологів фенолу, в умовах реакцій Реформатського, Кольбе — Шмітта, ціаногідринового синтезу та ін.
22. Амінокислоти, їх будова, номенклатура та медико-біологічне
значення.Амі́нокисло́ти — органічні сполуки, які одночасно містять у своєму складі аміно- (-NH2) та карбоксильну (-СООН) групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками. Більшість білків побудовані із комбінації дев'ятнадцяти «первинних» амінокислот, тобто таких, що містять первинну аміногрупу, і однієї «вторинної» амінокислоти або імінокислоти (містить вторинну аміногрупу) проліну, що кодуються генетичним кодом. Їх називають стандартними або протеїногенними амінокислотами. Крім стандартних в живих організмах зустрічаються інші амінокислоти, які можуть входити до складу білків або виконувати інші функції.
У залежності від того, до якого атому вуглецю приєднана аміно- група, амінокислоти поділяються на α-, β-, γ- і тощо.
Глікохолієва кислота бере участь у процесах засвоєння ліпідів, а у формі гіпурової кислоти з організму виводиться токсична бензойна кислота.Аланін як бічний ланцюжок входить до складу циклічних амінокислот (фенілаланін, тирозин, гістидин, триптофан). Біологічна роль визначається також наявністю його похідних (серин, цистеїн, цистин).Цистеїн. У тканинах організму легко здійснюється ферментативна окиснювально-відновна реакція, обумовлена наявністю в цистеїні реакційно здатної SH-групи. При цьому утворюється цистин.Властивість даної амінокислоти окиснюватися додає їй захисні і радіопротекторні властивості. У присутності цистеїну знижується інтенсивність окисних процесів у ліпідах і білках, підвищується стійкість організму до іонізуючого випромінювання і стабілізується дія прийнятих лікарських препаратів. При участі двох залишків цистеїну в поліпептидних ланцюгах утворюються дисульфідні зв'язки, що обумовлюють біологічну активність або функціональні властивості білків у складі їжі. Особливо важливу роль дисульфідні зв'язки грають у білках пшениці, тому що вони додають клейковині пружні властивості.
глутамінова і аспарагінова кислоти,вони беруть участь у процесах розщеплення, синтезу і переносу активних груп, часто у формі амідів.Глутамін, наприклад, є основною формою переносу аміаку в крові людини і разом з аспарагіновою кислотою служить попередником пиримідинового кільця нуклеотидів.Реакції декарбоксилювання глутамінової кислоти з утворенням g-аміномасляної кислоти, що відноситься до групи медіаторів центральної нервової системи, приділяється важлива роль в обміні речовин у мозку і нервовій тканині.З обміном глутамінової кислоти тісно зв'язаний обмін проліну, що синтезується з неї в результаті відновлення проліндегідрогеназою. Пролін відіграє важливу роль у формуванні структури колагену і білків пшеничної клейковини, викликаючи вигини в поліпептидних ланцюгах.З тирозину і триптофану, що містяться в їжі, при участі мікробних ферментів у кишечнику утворюються отрутні продукти – крезол, фенол, скатол, індол, знешкодження яких відбувається в печінці шляхом зв'язування із сірчаною або глюкуроновою кислотами з утворенням нетоксичних (парних) кислот, наприклад,фенол-сірчаної кислоти.
23. Специфічні властивості амінокислот.Існує близько 28 амінокислот. В організмі людини багато з них синтезується в печінці. Проте деякі з них не можуть бути синтезовані в організмі, тому людина обов'язково повинна отримувати їх з їжею. До таких незамінних амінокислот відносяться гістидин, ізолейцин, лейцин, лізин, метіонін, фенілаланін, треонін, триптофан і валін.
Амінокислоти, які синтезуються в печінці: аланін, аргінін, аспарагін, аспартову кислоту, цитрулін, цистерн, гамма-аміномасляну кислоту, глютамову кислоту, глютамін, гліцин, орнітин, пролін, серин, таурин, тирозин.
Процес синтезу білків постійно відбувається в організмі. У разі відсутності хоча б однієї незамінної амінокислоти, утворення білків припиняється! Це може привести до самих різних серйозних проблем - від порушення травлення до депресії і уповільнення росту. 19:50:13
24. Оксокислоти, їх будова, номенклатура та властивості.Фізичні властивості. Оксикислоти - безбарвні тягучі рідини чи кристалічні речовини. Нижчі добре розчинні у воді, зі збільшенням молекулярної маси розчинність зменшується.
Хімічні властивості. Оксикислоти взаємодіють з багатьма хімічними реакціями, характерних для кислот (присутність групи СООН) та спиртів (присутність групи ОН). Будова вуглецевого радикалу теж оказується на їх хімічній поведінці - ароматичні оксикислоти вступають у перетворення, характерні для відповідних похідних бензолу. У одних хімічних реакціях кожна з функціональних груп може приймати участь незалежно друг від друга. а в інших хід реакції та характер продуктів, які утворилися, залежить від їх взаємного впливу, у деяких випадках оксі- та карбоксильні групи можуть взаємодіяти між собою.
Кислотні властивості. Введення у молекулу кислоти оксігрупи підвищує силу кислоти: оксикислоти - більш сильні, чим відповідні їм карбонові кислоти.
Вони можуть утворювати солі, складні ефіри, аміди, галогенангідріди. У реакції з РСІ5 може взаємодіяти і спиртова група.
Окремі представники.Молочна кислота СН3-СНОН-СООН. Існує у природі у виді двух- оптичних антиподів та рацемат. Гігроскопічна сіропоподібна рідини. Найбільш важливий спосіб добування - молочнокислого бродіння:
Молочна кислота використовується у шкіряній промисловості при обробці шкіри, текстильній як протрави та в медицині. Велике використання вона знайшла у харчовій промисловості при виробництві цукерок, безалкогольних напоїв.
Яблучна кислота НООС-СН2-СНОН-СООН. Зустрічається у виді двох оптичних антиподів і рацемата. У рослинному мирі широко розміщена ліворухома L-яблучна кислота. Є одною із головних органічних кислот у яблуках, рябині, груші, кізилі.
Винна кислота НООС-СНОН-СНОН-СООН. Зустрічається у виді двох оптичних антиподів, рацемата і мезовиної кислоти.
Винна кислота у харчовій промисловості використовується при виробництві фруктових вод, хімічних розпушувачів тіста, у аналітичній хімії для визначення іонів калію, у медицині.
Лимона кислота СООН-СН2-С-СН2СООН. Кристалічна речовина, добре розчинна у воді. Лимону кислоту добувають із листків махорки, лимонів та біохімічним шляхом за допомогою гриба Aspergillusniger. Використовується у харчовій промисловості при виробництві цукерок, кремів, безалкогольних напоїв, у текстильній промисловості при фарбуванні тканин та медицині.
25. Кетонові тіла, схема утворення їх в організмі.Ацето́нові тіла́ (кето́нові тіла́) — група органічних речовин-проміжних продуктів обміну жирів (ацетон, β-оксимасляна та ацетооцтова кислоти), що утворюються в організмі при деяких хворобливих станах. Посилене утворення ацетонових тіл спричиняє інтоксикацію організму.Накопичення кетонових тіл при тривалому голодуванні, цукровому діабеті, нирковій глюкозурії, тобто в умовах обмеженої утилізації вуглеводів і посиленої мобілізації жирних кислот із депо, зумовлюється недостачею оксалоацетату, який приводить до гальмування включення ацетил-КоА в цикл лимонної кислоти і направлення його на синтез кетонових тіл.До кетонових «ацетонових тіл» відносяться:ацетооцтова кислота (ацетоацетат) - СН3-СО-СН2-СООН;В-оксимасляна кислота - СН3-СНОН-СН2-СООН ,ацетон - СН3-СО-СН3.
Утворення кетонових тіл відбувається у цитозолі (початкові етапи) та мітохондріях гепатоцитів.
На першому етапі 2 молекули ацетил-КоА конденсують з утворенням ацетоацетил-КоА (фермент 3-кетотіолаза).Ацетоацетил-КоА взаємодіє ще з однією молекулою ацетил-КоА (фермент мітохондріальна b-ГОМК-синтаза). Біосин-тез b-окси-b-метилглутарил-КоА під час утворення кетонових тіл відбувається у мітохондріях клітини. Якщо утворення b-ГОМК відбувається у цитозолі гепатоцитів, він використовується для біосинтезу холестеролу. Розщеплення b-ГОМК, що утворився до ацетоацетату та ацетил-КоА відбувається під дією мітохондріального ферменту b-ГОМК-ліази.Ацетоацетат відновлюється з участю НАД-залежної b-гідроксибутират-дегідрогенази до b-гідроксибутирату. Реакція перебігає в напрямку утворення b-гідроксибутирату за умов високого співвідношення в гепатоцитах НАДН/НАД+, яке буває при голодуванні.
26.Вуглеводи – органічні сполуки, до складу яких часто входять три хімічних елемента: Карбон, Гідроген і Оксиген. Багато вуглеводів крім цих елементів містять Фосфор, Сульфур і Нітроген. Дані біополімери широко поширені в природі. Біосинтез вуглеводів в рослинах здійснюється в результаті фотосинтезу. Вуглеводи складають близько 80-90% сухої маси рослин.Класифікація вуглеводів.Всі вуглеводи діляться на дві великі групи: моносахариди (прості вуглеводи або монози), полісахариди (складні вуглеводи або поліози), які складаються з декількох залишків молекул моносахаридів, пов’язаних між собою.Моносахариди, що містять альдегідну групу, називають альдози, а ті, які містять кетонну групу, – Кетоз. До простих вуглеводів належать альдегідів-і кетоспірти з числом вуглецевих атомів не менше трьох. За кількістю атомів карбону моноз деляться на тріози, тетрози, пентози, гексози і т.д.Дисахаріди – це вуглеводи, молекули яких при гідролізі розщеплюються на дві молекули гексоз. До дисахаридам відносяться мальтоза, сахароза, трегалоза, лактоза.Класифікація вуглеводів: гомополісахаріди і гетерополісахариди. До складу гомополісахаридів входить значна кількість залишків одного моносахариду: глюкози, Маноз, фруктози, ксилози і т.д. Вони є запасними (резервними) поживними речовинами для організму (глікоген, інулін, крохмаль). Молекули гетерополісахарідов складаються з великої кількості різних моносахаридів.
27. Стереохімічні (D-, L-) ряди моносахаридів. Проекційні формули
Фішера.Пізніше Е. Фішер дослідив просторову конфігурацію глюкози та
фруктози і запропонував для них сучасні проекційні формули: Перестановка будь-якої одної пари замісників приводить до зміни конфігурації хірального центру. Обертання у площині малюнка на 90° має сенс лише для формул молекул з одним хіральним центром і веде до зміни конфігурації (три перестановки). Дзеркальне відбивання формули (обертання на 180° з виходом із площини малюнку) змінює конфігурацію всіх хіральних центрів.Ці формули називаються відкритими або ланцюговими (карбонільними). 2.Ізомерія, зумовлена наявністю асиметричних атомів Карбону. Молекули моносахаридів містять кілька асиметричних атомів Карбону і тому існують у вигляді різних просторових ізомерів. Для зображення стереоізомерів на площині використовують проекційні формули Фішера. Ізомери моносахаридів поділяють на D- і L-стереохімічні ряди, приналежність до яких визначається за конфігурацією асиметричного атома Карбону, максимально віддаленого від карбонільної групи ( для пентоз – С-4, для гексоз – С-5). Якщо конфігурація цього хірального атома Карбону співпадає з конфігурацією D-гліцеринового альдегіду, то моносахариди відносяться до D-ряду, якщо співпадає з конфігурацією L-гліцеринового альдегіду – то до L-ряду.
28. Циклічні напівацеталі моносахаридів (піранози). Формули Хеуорса.Звичні напівацеталі утворюються при взаємодії молекул двох сполук – альдегіду і спирту. В процесі реакції розривається подвійний зв'язок карбонільної групи, по місцю розриву до якої приєднуються атом водню гідроксилу і залишок спирту.Найстійкіші (циклічні) напівацеталі утворюються за рахунок гідроксильних груп при четвертому і п'ятому вуглецевих атомах. Виникаючі при цьому п’ятичленні і шестичленні кільця називають відповідно фуранозноюі піранозною формами моносахаридів.Розглянемо побудову формул Хеуорса . a, D-глюкопіраноза b,
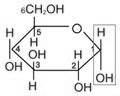
Циклічні напівацеталі моносахаридів (фуранози). Формули Хеуорса
a, D- глюкофураноза 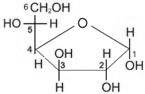 .
.
30. Реакційна здатність моносахаридів.Моносахариди мають властивості спиртів і карбонільних сполук.
1. Окиснення.a) Як і у альдегідів, окиснення моносахаридів призводить до відповідних кислот. Так, при окисленні глюкози аміачним розчином оксиду аргентуму утворюється глюконова кислота (реакція "срібного дзеркала"), але в лужному середовищі проходить і розклад молекули моносахариду .Реакція моносахаридів з гідроксидом купруму(ІІ) при нагріванні в лужному середовищі призводить до продуктів розпаду.2 Відновлення.Відновлення цукрів призводить до багатоатомним спиртів. Як відновник використовують водень в присутності нікелю, алюмогідрид літію .Реакції по гідроксильних групах моносахаридів здійснюються, як правило, в полуацетальной (циклічної) формі.1 Утворення простих ефірів.При дії метилового спирту в присутності газоподібного хлороводню атом Н глікозидного гідроксилу заміщується на метильну групу. 2. Утворення складних ефірів (естерів).
31. Дисахариди — найпростіші представники олігосахаридів, їх відновна
здатність (мальтоза, целобіоза, лактоза).Дисахариди (Дицукриди) — вуглеводи, які при нагріванні з водою в присутності мінеральних кислот чи під дією ферментів піддаються гідролізу, розкладаються на дві молекули моносахаридів. При окисленні дають альдонові кислоти, відновленні — спирти, при гідролізі — моносахариди. Відновлюючі проявляють окисно-відновні властивості. Дисахарид може утворювати відкриту форму, яка містить карбонільну групу, і вступати в окисно-відновні реакції.Мальтоза (солодовий цукор) складається з двух залишків глюкози.Лактоза (молочний цукор) складається із залишків галактози і глюкози.
32. Невідновні дисахариди (сахароза).Невідновні дисахариди
У молекулах невідновних дисахаридів глікозидний зв'язок утворюється за рахунок напівацетальних гідроксильних груп обох моносахаридів. Такі дисахариди не мають у своєму складі вільного напівацетального гідроксиду, тому в розчинах вони існують тільки в циклічній формі, їх розчини не мутаротують і не мають відновних властивостей. Не дають реакцій по альдегідній групі і глікозидному гідроксилу. Вони здатні лише до утворення етерів і естерів. Представником невідновних дисахаридів є сахароза.
Сахароза (тростинний або буряковий цукор). Молекула сахарози складається з залишків D-глюкози і D-фруктози.
33. Крохмаль як представник гомополісахаридів, його будова і гідроліз.Крохмаль – це природний полісахарид, утворений залишками α-глюкози. Крохмаль утворюється в рослинах при фотосинтезі. Склад молекули виражається формулою
( С6Н10О5 )п . Крохмаль – це природний полімер , який синтезується в рослинах із глюкози по реакції :
пС6 Н12О6→ (С6Н10О5)п + Н2,ОКрохмаль може піддаватися кислотному і ферментативному гідролізу. Так, в харчовому каналі під впливом ферментів амілази і мальтази молекула крохмалю розщеплюється до декстринів, мальтози і глюкози.Найважливіша хімічна властивість крохмалю — його гідроліз, кінцевим продуктом якого є глюкоза. Сумарне рівняння можна виразити так:
(С6Н10О5)n + nН2О -> nС6Н12О6
34. Амінокислотний склад пептидів і білків. Амінокислоти являючись будівельними блоками пептидів і білків, виконують і ряд інших важливих функцій. Деякі з них, мабуть приймають участь у передачі нервових імпульсів; прикладами служать гліцин і глютамінова кислота. В їжі повинні міститися незамінні амінокислоти, оскільки організм людини не здатен синтезувати їх в кількостях, достатніх для росту. В результаті метаболізму амінокислот утворюється багато сполук, які мають важливе біологічне значення. Наприклад, при декарбоксилуванні деяких амінокислот утворюються відповідні аміни, і деякі з них (гістамін, g-аміномасляна кислота (ГАМК)) виконують важливі біологічні функції. Ряд аномальних процесів, які виникають в організмах, пов’язані з порушенням транспорту амінокислот до клітин.
35. Структурна організація білків.Структурна організація білків; Амінокислоти, що входять до складу білкової молекули, взаємодіють між собою за рахунок a-карбоксильних та a-амінних груп сусідних амінокислот. При цьому утворюються амідні, або пептидні зв'язки. Залежно від їх кількості, розрізняють дипептиди, трипептиди тощо, олігопептиди, поліпептиди. Утворення пептидного зв'язку можна зобразити як відщеплення води від взаємодіючих карбоксильної та амінної груп сусідніх амінокислот: У молекулі білків група і багатократно повторюється, утворюючи скелет пептидного ланцюга: У кожному пептидному ланцюзі на одному кінці є вільна a-NH - група (N-кінцева амінокислота), а на другому – вільна a-СООН- група (С-кінцева амінокислота). Структуру пептидів зображують, починаючи з N-кінцевої амінокислоти, тобто нумерацію амінокислотних залишків проводять із N-кінця. Зрозуміло, що властивості пептидів і білків будуть залежати від кількості амінокислот, що входять до їх складу, виду амінокислот та порядку чергування їх у пептидному ланцюзі. Довжина пептидного ланцюга в пептидах і білках може коливатись у широких межах – від двох до сотні, а іноді тисяч амінокислотних залишків. Умовно всі пептидні сполуки, залежно від довжини ланцюга, ділять на олігопептиди (містять від 2 до 10 амінокислот), поліпептиди (від 10 до 40) і білки (більше 40). Якщо середньою молекулярною масою амінокислоти вважати 100 дальтон, то молекулярна маса пептидів буде знаходитись в межах 200-1000 дальтон; поліпептидів – 1000-4000, а білків– від 4-5 тисяч до декількох мільйонів.
36. Якісні реакції на α-амінокислоти. Реакції з нінгідрином: При нагріванні з водним розчином нінгідрину вільні a-амінокислоти утворюють сполуки синього або фіолетового. Реакція характерна для аміногруп, що знаходяться в a-положенні й використовується для виявленняa-амінокислот, розділених хроматографічним методом.Ця реакція заснована на тому, що безбарвний нингидрин, реагуючи з амінокислотою, конденсується у вигляді димеру через атом азоту, відщеплюється від а-аміногрупи амінокислоти. У результаті утворюється пігмент червоно-фіолетового кольору. Одночасно відбувається декарбоксилювання амінокислоти, що призводить до утворення С02 і відповідного альдегіду. Нінгідринова реакцію широко використовують при вивченні первинної структури білків
Переглядів: 1911