
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ПАСИВНИЙ СТАН МЕТАЛІВ
Дослідженнями встановлено, що в розчинах сильних окислювачів корозія деяких металів значно менше, ніж в слабкіших окислювачах. Такі метали, як хром, нікель, залізо, титан, алюміній, в розчинах деяких окислювачів практично не розчиняються. Це явище, здавалося б, що суперечить термодинамічним властивостям металу і окислювача, назвали пасивацією, а стан металу — пасивним.
У ширшому значенні пасивність — це стан підвищеної корозійної стійкості металу або сплаву в умовах, коли з термодинамічної точки зору вони цілком реакційноздатні, викликане гальмуванням переважно анодного процесу.
Останнє положення слід пояснити особливо. Згідно законам електрохімічної кінетики швидкість розчинення металу в агресивному середовищі (анодний процес) повинна збільшуватися при зрушенні потенціалу в позитивному напрямі.
Насправді, проте, така закономірність часто порушується. Досягнувши деякого максимального значення, швидкість розчинення металу різко падає, іноді на декілька порядків. Зниження швидкості розчинення звичайно починається досягши певного позитивного значення потенціалу, званого потенціалом пасивації. Таким чином, характерними ознаками пасивації є різке зниження швидкості розчинення металу і зрушення потенціалу його від рівноважного в позитивну сторону.
У пасивний стан метал можна перевести або пропусканням через нього анодного струму, або введенням в агресивне середовище яких-небудь окислювачів, що зсовують потенціал металу в позитивну сторону до значення потенціалу пасивації. У першому випадку пасивація наступає тільки тоді, коли густина анодного струму перевищить деяку критичну величину, в другому випадку — якщо концентрація окислювача перевищить деяке критичне значення. Цікаво, що після настання пасивації можна понизити величину анодного струму або концентрацію окислювача; пасивний стан металу при цьому може не порушитися. Проте у присутності деяких аніонів, наприклад галоїдів, все ж таки наступить активація пасивного металу.
Характерним прикладом пасивності, викликаної окислювачем, є різке зниження швидкості розчинення заліза в розчинах азотної кислоти (мал. 1). Настання пасивності, як випливає з цього малюнка, наступає при концентрації азотної кислоти близько 50 %. Викликають пасивність і такі окислювачі, як концентрована Н2SO4, K2CrO4, K2WO4, H2O2, O2, NaNO2. Ось тому концентровану сірчану кислоту можна перевозити в сталевих залізничних цистернах.
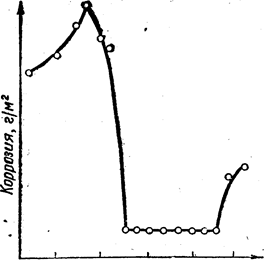
20 40 60 80 100 Концентрація НNO3, %
Малюнок 1. Залежність швидкості
корозії заліза від концентрації азотної кислоти
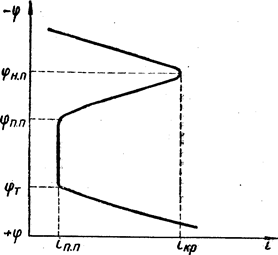
|
Малюнок 2. Потенциостатічеськая поляризаційна крива
Для вивчення пасивного стану метала звичайно одержують криві залежності швидкості розчинення і від потенціалу ? (рис.2)Найважливішими характеристиками здатності металу пасивуватися і зберігати пасивний стан є потенціал початку пасивації jН.П. критичний струм початку пасивації iкр, потенціал повної пасивації jП.П., струм повної пасивації iпп і потенціал почала перепассивациі jТ. Прі потенціалі початку пасивації наступає пасивний стан, швидкість розчинення металу відповідає при цьому iкр; jН.П. і iкр показують, наскільки легко метал переходить в пасивний стан. Чим отріцательнєє jН.П. і чим менше iкр, тим легше наступає пасивність. Досягши потенціалу повної пасивності jП.П. метал знаходиться в такому стані, коли швидкість його розчинення, відповідна iпп, мінімальна. У інтервалі потенціалів Dj = jТ - jП.П. зберігається стійкий пасивний стан. Чим більше Dj, тим в ширших межах зміни потенціалу зберігатиметься пасивність. При потенціалах, положітельнєє jТ, швидкість розчинення металу збільшується, наступає перепассивация. Таким чином, знання цих характеристик дозволяє передбачити корозійну стійкість металу в пасивному стані.
Причиною пасивного стану є освіта на поверхні металу адсорбційних або фазових шарів, що викликають гальмування процесу розчинення. Існують дві теорії пасивності: фазова і адсорбційна.
Згідно фазової теорії пасивний стан зв'язується з освітою на поверхні металу суцільних окисних або сольових плівок. Найчастіше плівка є оксидами нестехиометрічеського складу (наприклад, Fe8O11, Fe3O4 на залозі) товщиною в декілька десятків або сотень ангстрем. Плівка володіє електронною провідністю і є катодом по відношенню до металу. У порах плівки протікає анодний процес розчинення металу, що супроводжується утворенням оксидів, що захищають метал в цьому місці. Сама плівка також хімічно розчиняється або відбувається її катодне відновлення.
Таким чином, пасивність згідно фазової теорії є динамічною рівновагою між процесами утворення і розчинення пасивної плівки, а корозійна стійкість визначається досконалістю захисної плівки: кількістю пір, їх розмірами.
Відповідно до адсорбційної теорії пасивність обумовлена адсорбційними шарами кисню, окислювача або інших речовин, які, адсорбуючись на активних ділянках поверхні, насищають валентності поверхневих атомів металу, що приводить до зниження його хімічної активності.
В даний час ці дві теорії, взаємно доповнюючи один одного, злилися в адсорбційно-плівкову теорію, яка задовільно пояснює численні факти пасивного стану металів.
Властивість ряду металів пасивуватися використовується для захисту їх від корозії. Корозійна стійкість деяких металів, таких, як алюміній або магній, у воді або атмосфері обумовлена здатністю їх самопассивіроваться. Метали, що не володіють здатністю самопассивіроваться, в деяких умовах можуть бути переведені в пасивний стан шляхом легування елементами, що проявляють велику схильність до пасивності. Наприклад, висока корозійна стійкість неіржавіючих сталей обумовлена наявністю в них хрому, нікелю, молібдену, володіючих здатністю пасивуватися. Іншими способами підвищення корозійної стійкості металів і сплавів шляхом використовування їх здатності пасивуватися в певних умовах є анодний захист, введення в агресивне середовище окислювачів.
Переглядів: 1182