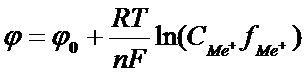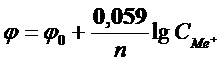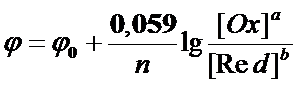- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Потенціометричний аналіз та іонометрія
План
Суть методу і області його використання Потенціометричний метод ґрунтується на залежності потенціалу електрода від складу розчину. При зануренні металевої пластинки в розчин на межі метал-розчин виникає електродний потенціал, величина якого залежить від складу і концентрації розчину, природи електрода і інших факторів. Виміряти потенціал одного електрода не можна, але можна виміряти електрорушійну силу (ЕРС) гальванічного елемента, якщо другим електродом буде, наприклад, водневий електрод. На електродах гальванічного елемента протікають напівреакції: При постійному потенціалі одного електрода (а стандартний потенціал водневого електрода умовно приймають за 0) можна за значенням ЕРС встановити відносну зміну потенціалу іншого електрода. Електрод, потенціал якого залежить від концентрації йонів в розчині, називають індикаторним електродом (приклади: хінгідронний, скляний – для реакцій нейтралізації; срібний і ртутний – для реакцій осадження і комплексоутворення; індиферентні метали (платина, паладій, золото) – для окисно-відновного титрування). Електрод, потенціал якого залишається постійним при зміні ЕРС, називається стандартним електродом, або електродом порівняння. Потенціометричний метод використовують метод для визначення концентрації йонів в розчині (пряма потенціометрія) і для потенціометричного титрування, коли еквівалентну точку визначають за різкою зміною потенціалу. Методом прямої потенціометрії визначають концентрацію йонів гідрогену (рН-метрія) і деяких інших йонів: K+, Na+, Cl-, F, NH4+ (іономерія).
Теоретичні основи методуЗалежність величини електродного потенціалу метала від концентрації йонів в розчині виражається рівнянням Нернста:
В розведених розчинах коефіцієнт активності близький до одиниці, тому в потенціометричному аналізі активність можна замінити концентрацією, шо не приведе до суттєвої похибки. При температурі 25°С і відповідних значеннях R, F і коефіцієнті перехода від натуральних логарифмів до десяткових рівняння Нернста записується таким чином: В ОВР [Ox] – концентрація окисленої форми йонів
ЕлектродиЗміна рівноважного потенціала електрода в залежності від концентрації (активності) йонів в розчині називається оберненістю електрода відносно даного катіона або аніона. У зв’язку з цим виділяють електроди першого і другого роду. Електроди І роду Метал, занурений в розчин солі того ж метала, утворює визначаючу потенціал електрода окисно-відновну систему. У такій системі потенціал електрода визначається лише відносно концентрації катіонів в розчині. Приклад: ртутний, срібний, амальгамні електроди, водневий. Електроди ІІ роду Метал, занурений в насичений розчин малорозчинної солі цього метала, що містить надлишок іншої солі з однаковим аніоном. В цьому випадку потенціал електрода визначається концентрацією відповідного аніона. Приклади: хлорсрібний, каломельний.
Йон-селективні електроди. ІонометріяІонометрія ґрунтується на використанні йонселективних електродів для визначення вмісту окремих йонів. Йонселективним електродом називають індикаторний або вимірювальний електрод з відносно високою специфічністю до окремого йону або типу йонів. Найпершим йонселективним електродом, який набув широкого використання, був скляний електрод, який використовується для вимірювання рН – активності йонів В наш час розроблені електроди для визначення хлорид-, фтори-, ціанід-йонів, іонів купруму, аргентуму, натрію і т. д. За видом використаних в електродах мембран вони поділяються на скляні, кристалічні і рідкі. Іонселективний електрод дозволяє виміряти активність іонів. Для отримання результатів в одиницях концентрації користуються виразом
Потенціометричне титруванняМетод потенціометричного титрування – титриметрія з потенціометричним визначенням кінцевої точки еквівалентності. Він полягає у вивченні зміни рівноважного потенціалу електроду в процесі хімічної реакції між потенціалвизначаючим компонентом в розчині і спеціально введеним в якості титранта реагенту. Метод дозволяє вести титрування в мутних і забарвлених середовищах, дає можливість визначати декілька компонентів в розчині і допускає автоматизацію процесу титрування. Практичне використання метода потенціометричного титрування здійснюється на приладах: потенціометрах, рН-метрах, різного роду титраторах. В практиці потенціометричного аналізу використовують компенсаційний і некомпенсаційний методи вимірювання ЕРС електродної пари. Цей метод застосовується в двох варіантах: метод титрування до нуля і з біметалічними електродами. Переглядів: 10668 Повернутися до змісту: Методи аналізу |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |