
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Кінетики
Oсновні поняття та визначення хімічної
Швидкість хімічної реакції Wце змінювання кількості будь-якої речовини (або вихідної, або продукту) ni за одиницю часу t та за одиниці реакційного простору R:
W = ± 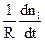
Цей вираз використовують зі знаком “плюс” , коли швидкість хімічної реакції визначають за змінюванням кількості продукту реакції (яка є позитивною), або зі знаком “мінус”, коли швидкість реакції визначають за змінюванням кількості будь-якої вихідної речовини (яка є негативною). У обох випадках швидкість реакції залишається позитивною.
Наведене визначення швидкості хімічної реакції є загальним, воно справедливе для будь-яких реакцій. Якщо реакція гомогенна та проходить у об’ємі, то реакційним простором є об’єм (R º V). Якщо реакція гетерогенна і проходить на поверхні розподілу фаз, то реакційним простором є ця поверхня
(R º S).
Найбільш теоретично описаними з точки зору хімічної кінетики є гомогенні реакції в ізольованих або закритих системах. Тому розглянемо на прикладі таких систем основні закономірності хімічної кінетики. Це можуть бути або газові реакції, або реакції між розчинами (за умови, що реагуюча суміш є однією фазою). У цьому випадку для швидкості хімічної реакції можна записати
W = ±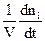 . (9.2)
. (9.2)
Якщо V = const, то враховуючи, що ni/V = Ci, де Сі – концентрація будь-якого компонента, можна записати
W = ± 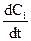 . (9.3)
. (9.3)
Вирішимо ще одне принципове питання. Нехай у системі проходить гомогенна реакція за участю речовин А, В, D, F:
аА + вВ  dD + fF
dD + fF
та концентрації речовин відповідно дорівнюють СА, СВ, СD i CF. Тоді для однозначного визначення швидкості реакції достатньо стежити за змінюванням концентрації однієї будь-якої речовини. Змінювання концентрацій усіх інших учасників реакції можна знайти із співвідношення
W = - 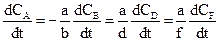 (9.4)
(9.4)
 Уведемо поняття про елементарну реакцію. Такою реакцією називається реакція, що проходить у відповідності до її рівняння, тобто за рахунок одночасного зіткнення молекул, що записані у лівій частині рівняння. Слід сказати, що з цих позицій у елементарній реакції можуть брати участь одна, дві або, що спостерігається дуже рідко, три молекули. Тому елементарні реакції підрозділяються на моно-, бі- та тримолекулярні.
Уведемо поняття про елементарну реакцію. Такою реакцією називається реакція, що проходить у відповідності до її рівняння, тобто за рахунок одночасного зіткнення молекул, що записані у лівій частині рівняння. Слід сказати, що з цих позицій у елементарній реакції можуть брати участь одна, дві або, що спостерігається дуже рідко, три молекули. Тому елементарні реакції підрозділяються на моно-, бі- та тримолекулярні.
Математичне рівняння, що пов’язує швидкість реакції з концентраціями речовин, що реагують, називають кінетичним рівняннямданої хімічної реакції. Слід зазначити, що за зовнішнім виглядом рівняння хімічної реакції не можна зробити висновок про її кінетичне рівняння (нагадаємо, що у хімічній термодинаміці за зовнішнім виглядом рівняння можна провести розрахунок різних величин, наприклад, константи рівноваги). Проілюструємо вищезазначене. Реакції водню з парами йоду або брому виражаються однаковими стехіометричними рівняннями. Однак кінетичні рівняння для них різні, саме:
Н2 + І2= 2НІ, 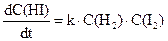
H2+ Br2 = 2HBr, 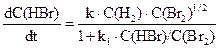
Це пояснюється тим, що перша реакція проходить як елементарна, у той самий час утворення HBr проходить у результаті складної ланцюгової реакції, механізм якої можна подати так:
Br2  2Br,
2Br,
Br + H2  HBr + H,
HBr + H,
H + Br2  HBr + Br.
HBr + Br.
Таким чином, кінетичне рівняння хімічної реакції може бути встановлене виключно експериментальним шляхом.
Основним законом хімічної кінетики є постулат, що випливає з великої кількості експериментальних даних і виражає залежність швидкості від концентрації. Цей закон, що отримав назву закону діючих мас, формулюється так:
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| Поняття про енергію активації хімічної реакції | | | Речовин, піднесених до деяких ступенів. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |