
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Способи визначення порядку реакції
Порядок реакції, у якому бере участь одна речовина, можна визначити, користуючись даними експериментів для двох різних початкових концентрацій С01 і С02. Тоді
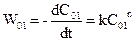 ,
,
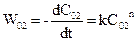 .
.
Логарифмуємо ці рівняння і отримуємо
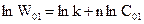 ,
,
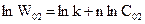 .
.
Віднімаємо рівняння одне із одного і отримуємо
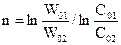 .
.
Для реакцій, у яких беруть участь дві вихідні речовини
аА + вВ  продукти,
продукти,
кінетичне рівняння має вигляд
W = k CAn(A) × CBn(B)
і задача зводиться до визначення часткових порядків реакції nA i nB , оскільки n = n(A) + n(B).
Для цього проводять дві серії експериментів: перша при постійній (або надлишковій) концентрації речовини А, друга при постійній (або надлишковій) концентрації речовини В. У обох модифікаціях концентрація однієї з речовин не буде впливати на швидкість реакції. Маємо
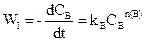 ,
,
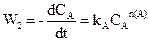 .
.
де kB = kCAn(A) i kA = kCBn(B). Після логарифмування отримуємо
lnW1 = lnkB + n(B) lnCB,
lnW2 = lnkA + n(A)lnCA.
Дослідні точки наносимо на графік з координатами lnW – lnC. Отримуємо дві прямі (рис.9.3). n(B)=tgj1, n(A)=tgj2, n=tgj1+tg j2.
Величини відрізків, що відсікаються прямими на осі ординат, дозволяють визначити k.
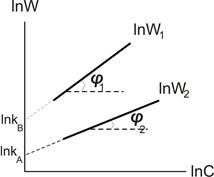
Рисунок 9.3 – До визначення порядку реакції
Подані способи називаються диференціальними.Крім того, існують інтегральніспособи визначення порядку реакції за експериментальними даними. Вони базуються на перевірці виконання кінетичних залежностей для реакцій різних порядків. Розглянемо ці способи.
1 Графічний спосіб.Як бачимо з рис. 9.2 та проведених нами розв¢язань кінетичних рівнянь для реакцій різних порядків, лінійна залежність f(c) – t реалізується у різних координатах. Для визначення порядку реакції будують усі чотири залежності (C-t; lnC-t; 1/C-t; 1/C2-t). Якщо, наприклад, графік, побудований за дослідними даними, виявився прямолінійним у координатах 1/С – t , то порядок реакції за розглянутою речовиною дорівнює двом.
2 Спосіб підстановки.Для різних моментів часу за формулами для реакцій можливих порядків розраховують значення константи k. Якщо розрахункові значення k за однією з формул не залежать від часу, то це означає, що ця формула відповідає реакції, що вивчається експериментально.
3 Спосіб часу напівперетворення.Послідовно обчислюємо t1/2 для декількох концентрацій за формулами для різних порядків, щоб встановити залежність t1/2 від початкової концентрації. Характер цієї залежності говорить про порядок реакції.
Висновки
Представлений кінетичний підхід до вивчення фізико-хімічних систем. Введено найважливіші поняття хімічної кінетики: енергія активації, швидкість гомогенної та гетерогенної хімічних реакцій, диференціальне кінетичне рівняння. Проведено класифікацію хімічних реакцій на прості і складні, введено поняття молекулярність і порядок хімічної реакції. Виконано рішення дифференциальних кінетичних рівнянь реакцій різних порядків і отримані численні інтегральні рівняння. Розглянуто основни диференціальні та інтегральні способи установлення порядку хімічних реакцій.
Читайте також:
- I визначення впливу окремих факторів
- II. Визначення мети запровадження конкретної ВЕЗ з урахуванням її виду.
- II. Мотивація навчальної діяльності. Визначення теми і мети уроку
- Ocнoвнi визначення здоров'я
- RLC-фільтр четвертого порядку
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Алгебраїчний спосіб визначення точки беззбитковості
- Аналіз службового призначення деталей та конструктивних елементів обладнання харчових виробництві, визначення технічних вимог і норм точності при їх виготовленні
- Аналіз стратегічних альтернатив та визначення оптимальної стратегії формування фінансових ресурсів
- Аналіз ступеня вільності механізму. Наведемо визначення механізму, враховуючи нові поняття.
| <== попередня сторінка | | | наступна сторінка ==> |
| Кінетична класифікація гомогенних хімічних реакцій | | | СТИСЛИЙ конспект лекцІй |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |