
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Гомологи бензолу
Бензол
Арени
С
2– крекінг метану: 2CH4 → C2H2 + 3H2
Добування інших алкінів
1 – з дигалогенопохідних: спирт
СН3 – СН – СН2 + 2КОН → СН3 – С ≡ СН + 2КСl + 2H2O
׀ ׀
Cl Cl
2 – з тетрагалогенопохідних:
Cl Cl
׀ ׀
СН3 – С – СН + 2Zn → СН3 – С ≡ СН + 2ZnCl2
׀ ׀
Cl Cl
3 – нарощування вуглецевого ланцюга:
СН ≡ СН + NaNH2 → CH ≡ CNa + NH3↑
CH ≡ CNa + Br – CH3 → CH ≡ C – CH3 + NaBr
| Вуглеводень Реактив | алкани | алкени | алкіни |
| бромна вода Br2 / H2O | – | знебарвлення | знебарвлення |
| перманганат калію KMnO4 | – | знебарвлення | знебарвлення |
| аміачний розчин аргентум оксиду Ag(NH3)2OH | – | – | білий осад |
| аміачний розчин купрум(І) оксиду Cu(NH3)2OH | – | – | червоний осад |
Розпізнавання алканів, алкенів, алкінів
· це вуглеводні, в молекулі яких є одно або більше ароматичних кілець (шість
атомів С замкнені в цикл і зв’язані одним спільним додатковим зв’язком –
ароматичним).
Електронна будова:
· тип гібридизації sp2
· валентний кут 120°
· форма молекули площинна
· хімічний зв’язок – ароматичний:у атомів, що знаходяться у стані
sp2 – гібридизації, залишається ще по одному негібридному р–електрону. р – орбіталі становляться перпендикулярно площині молекули, перекриваються боками по колу і утворюють єдину π – хмару:
 |
 πσ
πσ
| |||
 |
 4 · 1 + 2 = 6 електронів
4 · 1 + 2 = 6 електронів
бензол

 4 · 2 + 2 = 10 електронів
4 · 2 + 2 = 10 електронів
нафталін

4 · 3 + 2 = 14 електронів
антрацен
Фізичні властивості:
|
 | ||||||||||||||||||
 |  | |||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
 | ||||||||||||||||||
Загальна формула СnH2n–6




 СН3 С2Н5 СН3 СН3 СН3 Н3С – СН – СН3
СН3 С2Н5 СН3 СН3 СН3 Н3С – СН – СН3



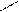


 СН3
СН3
 |  |  |  |  |  |

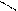 СН3
СН3
толуол етилбензол кумол
(метилбензол) о–ксилол м–ксилол СН3 (ізопропілбензол)
п–ксилол
Орієнтуюча дія замісників у бензольному кільці
Електронна π – хмара в молекулі бензолу симетрична, тому всі атоми С рівноцінні. Введення в молекулу бензолу замісника порушує симетріюπ – системи, призводячи до перерозподілу електронної густини у кільці. В результаті реакційна здатність бензольного кільця змінюється, в ньому з’являються частково заряджені центри, які й визначають місце введення у бензольне кільце наступного замісника.
· Електронодонорні замісникипідвищують електронну густину спряженої системи, оказуючи на неї активуючу дію, особливо в орто – і пара – положеннях, де створюються центри з частковим негативним зарядом:
R
 ↓
↓

 δ–В орто – і пара – положеннях
δ–В орто – і пара – положеннях
 δ–легко відбувається атака
δ–легко відбувається атака
електрофільних агентів, що
що призводить до реакцій
 заміщення.
заміщення.
δ–
· Електроноакцепторні замісникивідтягують на себе електронну густину спряженої системи, оказуючи на неї дезактивуючу дію, особливо в орто – і пара – положеннях, де створюються центри з частковим позитивним зарядом:
R
 ↑ В мета – положеннях можлива
↑ В мета – положеннях можлива
 δ+атака нуклеофільних агентів,
δ+атака нуклеофільних агентів,
 δ+що призводить до реакцій
δ+що призводить до реакцій
заміщення.
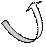
δ+
| Замісники І роду (електронодонорні, орто – і пара – орієнтанти) | Замісники ІІ роду (електроноакцепторні, мета – орієнтанти) |
| · Вуглеводневі радикали: – СН3 – С2Н5 – С3Н7 та ін. · Галогени: – F – Cl – Br – I · Гідроксогрупа – ОН · Аміногрупа – NH2 |  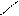 O
· O
·  Нітрогрупа – N Нітрогрупа – N
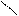 O O
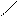  O
· O
·  Карбонільна група – C
H Карбонільна група – C
H
 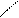 O
· O
· 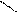 Карбоксильна група – C
OH
O
׀׀
· Сульфогрупа – S – OH
׀׀
O Карбоксильна група – C
OH
O
׀׀
· Сульфогрупа – S – OH
׀׀
O
|
 | |||||||||||||||||||
 |  |  | |||||||||||||||||
 | |||||||||||||||||||
 |  | ||||||||||||||||||
 |  | ||||||||||||||||||
 |
|
Читайте також:
- АРОМАТИЧНІ ВУГЛЕВОДНІ РЯДУ БЕНЗОЛУ
- Дизаміщені бензолу.
- СПОСОБИ ОДЕРЖАННЯ БЕНЗОЛУ ТА ЙОГО ГОМОЛОГІВ
- Суміш рівних об’ємів бензолу і води кипить при 69,2° С.
| <== попередня сторінка | | | наступна сторінка ==> |
| Добування ацетилену | | | Добування толуолу |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |
 AlCl3
+ СН3Cl → + HCl
2 – реакція Вюрца – Фіттіга:
Cl CH3
+ 2Na + CH3Cl → + 2NaCl
AlCl3
+ СН3Cl → + HCl
2 – реакція Вюрца – Фіттіга:
Cl CH3
+ 2Na + CH3Cl → + 2NaCl