
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лабораторна робота № 1
Тема: Будова світлопольного мікроскопу. Види мікроскопії
Мета: ознайомитися з особливостями роботи в мікробіологічній лабораторії та технікою безпеки. Вивчити будову світлопольного мікроскопу, його механічну та оптичну системи, типи сучасних мікроскопів та правила користування ними в мікробіологічній практиці
Матеріали й устаткування: мікроскопи МБР, МБД, набори об’єктивів та окулярів, конденсорів, предметні та покривні скельця, імерсійна олія
Теоретичні положення
Для вивчення морфології мікроорганізмів у прохідному світлі використовують оптичні мікроскопи МБР (рис. 1.1), МБД.
Механічна частина складається зі штатива з предметним столиком, тубуса, револьвера, механізму наведення різкості, що складається з макрометричного й мікрометричного гвинтів.
Оптична частина мікроскопа включає об'єктив і окуляр. Об'єктив є найважливішою частиною мікроскопа. Він складається із системи лінз, укладених у металеву оправу. Одне з позначень на оправі відповідає значенню збільшення об'єктива. В мікроскопі МБР використовуються об'єктиви, що дають збільшення в 8, 40 і 90 разів. Це багатолінзові короткофокусні системи, від якості яких залежить, в основному, зображення об’єкту. Збільшення об'єктива залежить від фокусної відстані головної – фронтальної лінзи. Чим більше кривизна фронтальної лінзи, тим коротше фокусна відстань, тобто тим нижче треба опускати об'єктив над площиною препарату. Інші лінзи називаються корекційними, вони необхідні для усунення сферичної й хроматичної аберації.
Об’єктив дає дійсне, збільшене, зворотне зображення предмету.
Окуляр містить дві лінзи – очну (верхню) і польову або збірну (нижню). Польові лінзи збирають промені, які йдуть від об’єктиву. Очна лінза збільшує зображення, яке дає об’єктив. Окуляри можуть давати збільшення в 5, 7, 10, 12, 15 і 20 разів, що зазначено на їхній оправі.
Окуляр дає збільшене, уявне, пряме зображення по відношенню до зображення, яке дає об’єктив. Окуляри можуть бути різних типів, їх вибір залежить від об’єктивів.
Освітлювальна система включає дзеркало з двома поверхнями (увігнутою та плоскою) і конденсора (у мікроскопі МБД є убудоване джерело світла). Увігнуте дзеркало збирає й концентрує в площині препарату пучок рівнобіжних променів світла, що йдуть від джерела світла, тому їм користаються в тих випадках, коли працюють без конденсора, тобто з малим збільшенням. Конденсор, укріплений безпосередньо над дзеркалом, складається з двох лінз і призначений для збирання паралельних променів світла, відбитих дзеркалом, у

Рис. 1.1. Мікроскоп МБР-1:
1 – основа мікроскопа; 2 – предметний столик; 3 – гвинти для переміщення предметного столику; 4 – клеми для фіксації препарату; 5 – конденсор; 6 – кронштейн конденсора; 7 – гвинт, що закріплює конденсор у гільзі; 8 – гвинт переміщення конденсора; 9 – ручка ірисової діафрагми конденсора; 10 – дзеркало; 11 – тубусоутримувач; 12 – макрометричний гвинт (кремальєра); 13 – мікрометричний гвинт; 14 – револьвер; 15 – об’єктиви; 16 –тубус; 17 –гвинт для кріплення тубуса; 18 – окуляр.
крапці-фокусі, що знаходиться в площині препарату. Убудована в конденсор ірисова діафрагма служить для затримання зайвих променів світла і дозволяє при необхідності зменшувати апертуру конденсора.
Загальне збільшення, що дає мікроскоп, визначається добутком збільшення об'єктива на збільшення окуляра. Виразність одержуваного зображення характеризується дозвільною здатністю, що визначається мінімальною відстанню між двома крапками, коли вони ще не зливаються в одну.
Величина дозвільної здатності мікроскопа залежить від довжини хвилі використовуваного світла (l) і суми числових апертур об'єктива (A1) і конденсора (A2):
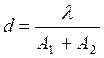 (1.1)
(1.1)
Числова апертура (A) визначається добутком синуса половини кута охоплення лінзи (U)та показника заломлення середовища (n), що граничить із лінзою: A = sin U·n. Тобто числова апертура характеризується кількістю променів, що попадають у лінзу (рис. 1.2).
Дозвільна здатність мікроскопа – величина, зворотна дозвільної відстані. Чим більше дозвільна здатність, тим меншої величини об'єкт можна побачити. Світловий мікроскоп за умов використання видимого світла має дозвільну здатність близько 0,2 мкм.
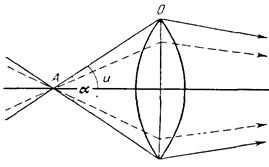 |
Рис 1.2. Схема ходу променів із різною величиною отвірного кута:
А – об’єкт;
О – об’єктив;
a - отвірний кут;
U – половина отвірного кута.
Підвищити дозвільну здатність можна двома шляхами: висвітлюючи об'єкт більш короткими променями світла, наприклад, УФ, або, збільшуючи показник середовища, що граничить із лінзою, для того, щоб наблизити його до показника заломлення скла (n скла = 1,5). У вивченні мікроорганізмів майже постійно користаються імерсійним, або олієзануреним об'єктивом (90х), що дає збільшення у 900–1350 разів (рис. 1.3).
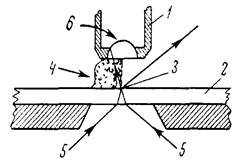 Рис 1.3. Вплив імерсійної олії на хід променів у мікроскопі:
Рис 1.3. Вплив імерсійної олії на хід променів у мікроскопі:
1 – об’єктив;
2 – предметне скло;
3 – об’єкт;
4 – імерсійна олія;
5 – промені світла;
6 – фронтальна лінза об’єктива.
Тому всі промені, не переломлюючись і не змінюючи свого напрямку, потрапляють в об'єктив і забезпечують гарну видимість дрібних об'єктів.
Мікроскопія в темному полі. Основи цього методу розроблено австрійським вченим Р. Зігмонді, він дає можливість підвищувати дозвільну здатність мікроскопу в 10 разів і використовується для дослідження об'єктів малої величини. Для цього в біологічному мікроскопі звичайний конденсор заміняють спеціальним конденсором темного поля, що має затемнену середню частину і пропускає тільки бічні промені.
Таким чином, мікроскопія в темному полі базується на висвітленні об'єкта косими променями світла (явище Тиндаля). Ці промені, не потрапляючи в об'єктив, залишаються невидимими для ока, тому поле зору виглядає зовсім чорним (рис. 1.4).
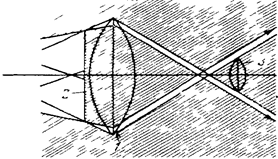 |
Рис. 1.4. Схема ходу променів у конденсорі темного поля:
1 – лінза конденсора;
2 – чорна пластинка;
3 – об’єктив.
Якщо препарат містить якісь частки, наприклад, мікроорганізми, то косі промені, проходячи через такий препарат, у значній мірі відбиваються від поверхні цих часток і, ухиляючись від свого первісного напрямку, попадають в об'єктив. Тоді спостерігач бачить на чорному фоні інтенсивно світні об'єкти з різким бічним контрастом. При цьому апертура конденсора повинна бути трохи більше апертури об'єктива (об'єктив необхідно діафрагмувати, а конденсор імергувати). Метод темного поля використовується для спостереження живих клітин мікроорганізмів.
Фазово-контрастна мікроскопія. Метод запропоновано голландським фізиком Ф. Церніке для спостереження за живими об’єктами.
Більшість препаратів живих мікроорганізмів слабо контрастні, тобто клітини мало відрізняються за забарвленням і прозорістю від навколишнього середовища. Проте світлова хвиля набуває певних змін: проходячи через ділянки препарату, що мають більший, ніж у навколишнього середовища показник заломлення, вона виходить із деяким відставанням за фазою. Спеціальний фазово-контрастний пристрій дозволяє оптичним шляхом перетворювати розходження за фазою в зміни амплітуди, у результаті чого живі прозорі об'єкти стають контрастними, їх можна побачити оком.
Оптична система, яка використовується для одержання фазового контрасту, складається з фазової пластинки в одній з лінз об'єктива, що має форму кільця, і кільцевої діафрагми в спеціальному конденсорному пристрої. Для одержання фазового ефекту необхідне точне сполучення фазового кільця з проекцією кільцевої діафрагми (рис. 1.5).
Метод фазового контрасту застосовується для дослідження живих клітин мікроорганізмів різних систематичних груп, контрастність яких досягається оптичним шляхом без втручання в фізіологічні процеси об’єктів, що вивчаються.
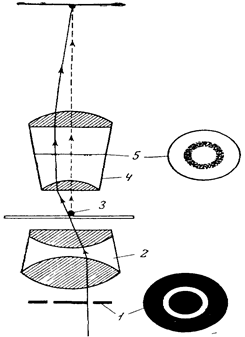 |
Рис. 1.5. Схема ходу променів із використанням фазово-контрастного пристрою:
1 – кільцева діафрагма;
2 – конденсор;
3 – об’єкт;
4 – об’єктив;
5 – фазова пластинка.
Люмінесцентна (флуоресцентна) мікроскопія. Вперше феномен люмінесценції для мікроскопічних досліджень було використано австрійським ученим А. Келером.
Деякі біологічні об’єкти здатні при освітленні короткохвильовими променями (синьо-фіолетовими, ультрафіолетовими) поглинати їх і випромінювати промені з більш довшою хвилею, при цьому виникає світіння жовто-зеленим або оранжевим кольором. Таке явище називається власною, або первинною, люмінесценцією.
Об’єкти, яким не притаманна первинна люмінесценція, можна обробити спеціальними флуорохромами (акридином жовтим, акридином оранжевим, аураміном, примуліном, конго червоним, тетрацикліном, хініном) і також спостерігати люмінесценцію, але це вже буде наведена, або вторинна люмінесценція. Препарати, забарвлені флуорохромами, вивчають на середовищах, що не здатні до люмінесценції (воді, гліцерині, фізіологічному розчині).
Оптична схема люмінесцентного мікроскопу відрізняється від схеми звичайного вибором джерела світла, а саме, заміною низько вольтової лампи на ртутну і наявністю на шляху променів двох світлофільтрів (синій – перед конденсором пропускає синьо-фіолетові промені видимого спектру, жовтий світлофільтр в окулярі мікроскопу гасить синьо-фіолетові промені, які заважають виявленню люмінесценції). Люмінесцентна мікроскопія – поєднання кольорового зображення з контрастністю об’єктів, дає можливість спостерігати за морфологією живих та мертвих клітин мікроорганізмів, досліджувати клітинні мікроструктури та функціонально-морфологічні зміни в клітині.
Електронна мікроскопія. Перший прототип сучасного електронного мікроскопа було побудовано радянським вченим Е. Руске. В електронному мікроскопі замість світлових променів використовують пучок електронів, які мають хвильові властивості. Нині широко використовують два типи електронних мікроскопів: трансмісійний і растровий.
В трансмісійному електронному мікроскопі пучок електронів рухається прямолінійно в безповітряному просторі від джерела електронів (розжарена нитка вольфрамової гармати) крізь досліджуваний об’єкт у напрямі до флуоресцентного екрану і викликає його світіння.
При дослідженні морфологічних особливостей клітин мікроорганізмів, їх товщина не повинна перевищувати 0,8–0,9 мкм. Контрастність зображення досягається за рахунок напилювання на досліджуваний об’єкт важких металів (хрому, золота, паладію) або обробки фосфорно-вольфрамовою кислотою і уранілацетатом.
Растровий електронний мікроскоп дозволяє отримувати об’ємне, тривимірне зображення об’єкта. Для цього тонкий рухомий електронний промінь дуже швидко і послідовно оббігає поверхню клітини і передає отриману інформацію на електронно-променеву трубку, що вкрита люмінофором.
Препарати для цього типу електронних мікроскопів піддають спеціальній обробці, основна мета якої – зневоднення об’єкту без порушення поверхні структур. Потім препарат вкривають тонким шаром сплаву золота або платини, що робить поверхню зразка електропровідною і дозволяє уникнути накопичення електричного заряду, який може знизити дозвільну здатність мікроскопа.
Порядок виконання роботи
1. Ознайомитися з правилами поведінки й техніки безпеки в мікробіологічній лабораторії.
2. Ознайомитися з будовою світлопольного мікроскопу (монокуляри, бінокуляри), які використовуються при виконанні лабораторних робіт з дисципліни.
3. Вивчити основні види мікроскопії, які застосовуються для дослідження живих клітин мікроорганізмів, а також встановити їх переваги та недоліки.
4. Визначити можливі варіанти загального збільшення світлопольного мікроскопу та його дозвільної здатності.
5. Замалювати малюнки згідно методичним вказівкам, зробити необхідні обчислення та висновки.
Лабораторна робота №2
Тема: Мікроскопічні дослідження мікроорганізмів різних систематичних груп. Прості методи забарвлення
Мета: освоїти методики приготування препаратів живих і фіксованих забарвлених мікроорганізмів та техніку мікроскопії
Матеріали й устаткування:постійні препарати культур мікроорганізмів різних систематичних груп (Streptococcus lactis, Micrococcus lisodeikticus, Lactobacillus acidophylum, Streptomyces recifensis, Staphylococcus aureus, Lactobacterium plantarum, Bacillus subtilis та ін.), природні субстрати, мікроскопи, предметні і покривні скельця, крапельниці з водою, бактеріологічні петлі, препарувальні голки, імерсійна олія, метиленовий синій, спиртівка (брикети сухого пального), кювета з містком для фіксованих препаратів, бензин, серветки, фільтрувальний папір, промивалка з дистильованої водою, розчин, що дезінфікує
Теоретичні положення
Мікроскопічні дослідження мікроорганізмів проводять в живому або фіксованому стані. Мікроскопія мікробних клітин в живому стані застосовується головним чином для вивчення їх розмірів, форми, структури, рухомості, характеру розмноження, відношення клітин до різних хімічних подразників. З цією метою найчастіше готують препарати роздавлена та висяча краплі.
Метод «роздавленої краплі». На чисте знежирене предметне скло мікробіологічною петлею наносять краплю суспензії мікроорганізмів. Якщо в культурі розвилося дуже багато бактерій, її розводять водою.
Покривне скло ставлять на ребро з краю краплі і поступово опускають на неї. Між скельцями не повинно залишатися пухирців повітря, які заважатимуть мікроскопії. Крапля повинна бути невеликою, щоб після «роздавлювання» рідина не виступала за край покривного скла. Препарат розглядають із сухою системою.
Метод «висячої краплі». Препарат «висяча крапля» використовують для виявлення рухливості мікроорганізмів. Крім того, можна довгостроково спостерігати за життєдіяльністю мікроорганізмів: розмноженням, утворенням і проростанням спор.
Для готування препарату невелику краплю суспензії мікроорганізмів наносять на покривне скло, перевертають його краплею вниз і поміщають на спеціальне предметне скло з поглибленням (лункою) у центрі. Крапля повинна вільно висіти, не торкаючись країв і дна лунки. Край лунки попередньо змазують вазеліном. Крапля виявляється герметично замкненою у вологій камері, що дозволяє багатоденне спостерігання за об'єктом.
Препарати розглядають під мікроскопом, злегка затемнюючи поле зору; конденсор трохи опускають, надходження світла регулюють увігнутим дзеркалом. З невеликим збільшенням знаходять край краплі, що буде чітко видний у затемненому полі зору. Край краплі пересувають у центр полю зору мікроскопа і переводять на велике збільшення, розширивши при цьому діафрагму. Більш чіткі результати можна одержати у темнопольній або фазово-контрастній мікроскопії.
Препарат «відбиток». Ці препарати є зручними для вивчення природного розташування клітин у колонії мікроорганізмів й особливо для дослідження форми спор і спороносців актиноміцетів і грибів.
З агаризованої пластинки, на якій мікроорганізми виросли суцільним газоном, вирізають скальпелем невеликий блок і переносять на предметне скло так, щоб поверхня з мікроорганізмами була обернена нагору. Потім до газону прикладають чисте покривне скло і негайно знімають, намагаючись не зрушити убік. Отриманий препарат поміщають відбитком униз у краплю води (можна в краплю метиленового синього) на предметне скло і розглядають під мікроскопом із сухою системою. Такий відбиток можна одержати і на предметному склі, якщо торкнутися ним поверхні колонії. Відбитки можна фіксувати й забарвлювати будь-яким способом.
Дослідження фіксованих забарвленихпрепаратів – найбільш розповсюджений мікробіологічний метод для виявлення морфологічних особливостей, кількісного обліку мікроорганізмів, а також для перевірки чистоти культури. Фіксовані забарвлені препарати можуть зберігатися тривалий час і розглядаються з імерсійною системою. Їхнє готування включає наступні етапи: виконання мазка, висушування, фіксацію й забарвлення.
У простому забарвленні мікроорганізмів застосовують якийсь один з основних анілінових барвників: метиленовий синій, основний фуксин, генціановий фіолетовий, кристалічний фіолетовий. Профарбовується вся клітина.
Готування мазка. За допомогою стерильної бактеріологічної петлі чи піпетки нанести на знежирене предметне скло краплю суспензії мікроорганізму.Матеріал із густого живильного середовища узяти бактеріологічною петлею і внести його в краплю стерильної водопровідної води. Матеріал рівномірно тонким шаром розподілити на площі 1–2 см2.
Висушування мазка. Висушити приготовлений мазок при кімнатній температурі у повітрі. Тонкий мазок висихає дуже швидко. Якщо висушування мазка уповільнене, препарат можна злегка нагріти в струмені теплого повітря, тримаючи предметне скло високо над полум'ям пальника мазком нагору. Цю операцію проводять дуже обережно, не перегріваючи мазка, інакше клітини мікроорганізмів деформуються.
Фіксація дає можливість швидко перервати протікання життєвих процесів у живому об’єкті, зберігаючи його тонку структуру. Фіксація переслідує кілька цілей: забезпечити прикріплення клітин до скла; зробити мазок більш сприйнятливим до забарвлення, оскільки мертві клітини забарвлюються краще, ніж живі; зробити безпечним подальші маніпуляції з мазком, що важливо в роботі з патогенними мікроорганізмами.
Найпростіший і розповсюджений спосіб фіксації – термічна обробка. Після висушування мазок зафіксувати в полум'ї пальника. Тримаючи скло мазком нагору, тричі провести його через гарячу частину полум'я пальника. Щоб уникнути перегріву, час прямого впливу полум'я не повинний перевищувати 3–4 с. Крім жару фіксацію можна робити хімічними речовинами, для цього використовують 96 %-ний етиловий спирт (час фіксації 5–10 хвилин), суміш Нікіфорова (спирт : ефір – 1 : 1; час фіксації 10–15 хвилин); ацетон (5 хвилин) та ін.
Забарвлення. Фіксований препарат помістити мазком нагору на місток із двох паралельних скляних паличок, з'єднаних гумовими трубками, що знаходяться на стінках кювети чи кристалізатора. Нанести на нього 2–3 краплі барвника (кінець піпетки не повинний торкатися мазка!) на 2–3 хвилини. Під час фарбування розчин барвника на мазку не повинний підсихати, при необхідності доливати нові порції. Для одержання більш чистих препаратів барвник наливають на мазок, покритий фільтрувальним папером. По закінченні фарбування препарат промивають водою доти, поки стікаюча вода не стане безбарвною. Потім препарат висушують у повітрі і промокають фільтрувальним папером.
Існують прості і диференційовані методи забарвлення. При простому забарвленні використовують один який-небудь барвник, наприклад метиленовий синій, фуксин, генціанфіолетовий в лужних або карболових розчинах. При цьому фарбується вся клітина. При диференційованому забарвленні різними барвниками забарвлюються тільки окремі структури клітини. Наприклад – метод забарвлення за Грамом, забарвлення спор, джгутиків, нуклеоїду та ін.
Барвники за хімічною природою розподіляються на кислі та лужні. Їх також поділяють на позитивні й негативні. З барвників, які застосовуються в мікробіологічній практиці, більшість відноситься до позитивних. Вони забарвлюють всю клітину при кімнатній температурі протягом 30–60 с. Негативні барвники забарвлюють проміжки, які оточують клітини мікроорганізмів. В результаті клітини виглядають силуетами на фоні барвника.
Правила роботи з імерсійним об'єктивом. Після установлення освітлення приготовлений сухий пофарбований препарат спочатку розглядають із невеликим збільшенням під об'єктивом сухої системи (8х, 40х). Знайшовши найбільш удале місце на ньому, препарат закріплюють затисками на столику мікроскопа. Тубус мікроскопа піднімають і, повертаючи револьвер, установлюють імерсійний об'єктив. Потім у центр препарату на мазок, не знімаючи зі столика мікроскопа, наносять краплю імерсійної (кедрової) олії і, дивлячись збоку, обережно опускають тубус мікроскопа до занурення об'єктива в олію. Стежать за тим, щоб фронтальна лінза не торкнулася предметного скла і не одержала ушкодження. Після цього, дивлячись в окуляр, макрометричним гвинтом повільно піднімають об'єктив до появи в полі зору досліджуваного об'єкта. Фокус уточнюють за допомогою мікрометричного гвинта.
Після роботи кедрову олію негайно видаляють з об'єктива серветкою, що змочена очищеним бензином. Ксилол і спирт використовувати не рекомендується, тому що вони можуть викликати розклеювання лінз об'єктивів.
У правильно забарвленому і добре промитому препараті поле зору залишається світлим і чистим, а пофарбованими залишаються клітини мікроорганізмів.
Порядок виконання роботи
1. Приготувати й провести мікроскопічне дослідження прижиттєвих препаратів мікроорганізмів за методами «висяча» та «роздавлена» краплі.
2. Зробити препарат «відбиток».
3. Приготувати для мікроскопічного дослідження препарати фіксованих забарвлених клітин мікроорганізмів простим способом та виконати мікроскопію з імерсією.
4. Вивчити препарати. Результати занести до зошита у вигляді малюнка. Зробити висновки.
5. Препарати, перш ніж вимити, поміщають у судину з дезінфікуючим розчином.
Лабораторна робота № 3
Тема: Морфологія бактерій і актиноміцетів
Мета: вивчити морфологічну різноманітність прокаріотичних організмів (бактерій і актиноміцетів)
Матеріали й устаткування: природні субстрати (кисляк, кефір, настій сіна, біогумусу, розсіл квашеної капусти, гниле м'ясо й ін.) і постійні препарати з культур мікроорганізмів різних морфологічних груп (Streptococcus lactis, Micrococcus lisodeikticus, Lactobacillus acidophylum, Streptomyces recifensis, Lactobacterium plantarum й ін.), культури актиноміцетів, що виросли на чашках Петрі, мікроскопи МБР, МБД, стерильні піпетки на 1–2 мл, бактеріологічна петля, пінцет, препарувальна голка, тонкі предметні стекла, покривні скельця, у тому числі з лункою, спиртівка (брикети сухого пального), кювета з містком для фіксованих препаратів, крапельниці з фарбами: метиленовий синій (1:40), водний розчин фуксину основного, генціанвіолет, стерильний розчин чорної туші (1:9); імерсійна олія, бензин, серветки, фільтрувальний папір, розчин, що дезінфікує, промивалка з дистильованої водою
Читайте також:
- II. Будова доменної печі (ДП) і її робота
- IV. ІНДИВІДУАЛЬНА РОБОТА СТУДЕНТІВ.
- IV. Практична робота.
- VI. Домашня робота.
- VI. Практична робота .
- VI. Практична робота .
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
| <== попередня сторінка | | | наступна сторінка ==> |
| Правила безпечної роботи із застосуванням пального | | | Теоретичні положення |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |