
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Розчинах при 298 К
| Концентрація, кмоль/м3 | λ, См ∙м2 ∙ кмоль | |||||
| КСl | AgNO3 | HCl | KOH | CH3COOH | NH4OH | |
| 1,0 | 9,83 | 6,78 | 30,1 | 18,4 | 0,132 | 0,089 |
| 0,1 | 11,20 | 9,43 | 35,1 | 21,3 | 0,46 | 0,330 |
| 0,01 | 12,24 | 10,78 | 37,0 | 22,8 | 1,43 | 0,960 |
| 0,001 | 12,73 | 11,32 | 37,7 | 23,4 | 4,10 | 2,800 |
| 0,0001 | 12,91 | 11,50 | - | - | 10,70 | 6,600 |
В безмежно розведеному розчині досягається повна дисоціація молекул (α = 1) і взаємодія між іонами відсутня. Кожний з іонів рухається незалежно від інших і еквівалентна електропровідність в такому випадку може бути представлена як сума електропровідностей іонів. Та частина еквівалентної електропровідності, яка приходиться на іони одного виду, називається рухливістю іону.
Еквівалентна електропровідність при великому розбавленні розчину дорівнює сумі рухливостей іонів:
λ∞ = la+ lk
де laі lk - рухливість аніона і катіона.
Це рівняння називається законом незалежного руху іонів або законом Кольрауша(німецький фізик).
Рухливість іонів виражається в тих самих одиницях, що й еквівалентна електропровідність: [ l ] =  =
= 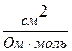
Знаючи рухливість іонів, за законом Кольрауша можна розрахувати еквівалентну електропровідність при безмежному розбавленні.
Рухливість іонів пропорційна швидкості їх руху в електричному полі і тому залежить від розмірів і степені гідратації іонів.
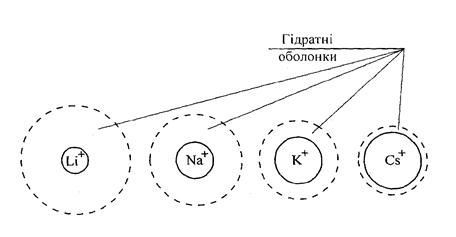 |
Чим більший радіус іону і чим вищий ступінь його гідратації, тим менша рухливість. Досить високу рухливість мають іон гідрогену Н+ і гідроксид іон ОН-. Це пояснюється тим, що механізм переміщення цих іонів у воді відрізняється від механізму руху інших іонів.
Рис.14. Відносні розміри іонів лужних металів (суцільні кола) та розміри цих іонів у гідратних оболонках (пунктирні кола).
В водних розчинах іон гідрогену знаходиться у вигляді гідроксонія Н3О+. В електричному полі протон іону гідроксонію переходить до найближчої молекули води. Знов утворений іон гідроксонію передає свій протон наступній молекулі води. Аналогічно переміщується протон в розчині від молекули води до гідроксид-іону. В обох випадках перенесення електрики здійснюється не рухом іонів, а в результаті перестрибування протону від одної частинки до іншої.

 _ Н2О Н2О Н2О Н3О+ Н2О Н2О +
_ Н2О Н2О Н2О Н3О+ Н2О Н2О +
_ Н2О Н2О Н2О ОН- Н2О Н2О +
Оскільки протон в молекулі води зв’язаний міцніше, ніж в (Н3О+) гідроксонії, то рухливість гідроксид-іону менша, ніж рухливість іонів гідрогену.
Читайте також:
- Кладка на розчинах з протиморозними хімічними добавками
- КЛАСИФІКАЦІЯ ТА СУТНІСТЬ МЕТОДІВ ВИЗНАЧЕННЯ СУХИХ РЕЧОВИН У РОЗЧИНАХ
- Реакції в розчинах електролітів. Іонні рівняння
- Реакції обміну в розчинах електролітів.
- Розчинення в розчинах електролітів
- ТЕМА: Теорія сильних та слабких електролітів. Рівновага в розчинах малорозчинних електролітів. Теорії кислот та основ. Дисоціація води. рН
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Вимірювання електропровідності |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |