
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція 4. Антитіла, їх будова і властивості.
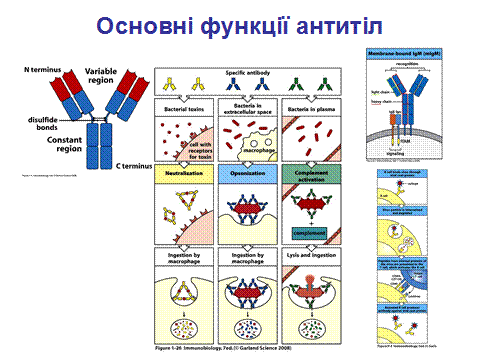
Антитіла виконують ряд функцій, спрямованих на елімінацію АГ, як то: розпізнають і зв’язують АГ, допомагають у його презентації макрофагам і лімфоцитам, зумовлюють ушкодження мастоцитів, активують систему комплементу і т. д.
Але основними на сьогодні є 3 функції. Перший і власне прямий шлях, за яким антитіла можуть працювати в системі захисту проти патогенів та їх продуктів - це зв’язування останніх і таким чином блокування їх доступу до клітин, які вони можуть інфікувати чи зруйнувати (ліва панель на рис.1.26). Цей процес отримав назву нейтралізація (1 функція), є важливим в антивірусному захисті, попереджаючи проникнення вірусів у клітину і їх подальшу реплікацію, а також відіграє певну роль в захисті проти бактеріальних токсинів. Незв’язані токсини можуть реагувати з рецепторами на клітині – хазяїні, в той час як комплекс токсин-антитіло не має можливості утворити такий зв’язок. На останньому етапі комплекс антиген – антитіло кінець кінцем видаляється і деградує з залученням системи макрофагів.
Ряд бактерій ухиляються від системи природного імунітету, тому що можуть мати таку характерну зовнішню оболонку (S-білковий шар+клітинна стінка+ бактеріальна цитоплазматична мембрана), яка не розпізнається образ – розпізнаючими (pattern recognition receptors) рецепторами фагоцитів. Однак антигени оболонки можуть розпізнаватись антитілами, а фагоцити, в свою чергу, містять рецептори, які зв’язують ці антитіла, що потім приводить до руйнації бактеріальної клітини шляхом фагоцитозу (середня панель на рис. 1.26). Прикріплення антитіл до поверхні патогенів чи чужорідних часточок з подальшою їх елімінацією отримало назву опсонізація (2 функція).
І третя функція антитіл – активація комплементу. Комплемент в першу чергу є частиною системи природного імунітету, хоча на правій панелі рис.1.26 - активація системи комплементу за класичним шляхом, при якій відбувається зв'язування імунних комплексів [АГ-АТ] з ферментним комплексом С1 системи комплементу, що фактично поєднує систему природного (комплемент) і набутого (антитіла).
Тому і назва « комплемент» походить від підсилення (доповнення) =complement активності антитіл.
До функцій антитіл як частини В-клітинного рецептора належать: а) пряма активація В-клітин при взаємодії з деякими бактеріальними антигенами, б) представлення антигенів в комплексі з молекулами МНС II системі Т-клітинного імунітету. (Рис. 6.9; 9.4).
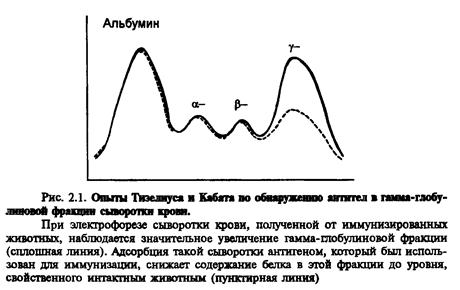
Природу антитіл було визначено тільки в середині XX століття. У 1937-1939 році Ян Тізеліус і Кабот провeли електрофорез білків сироватки крові та визначили, що вони поділяються на альбуміни та альфа1-, альфа2-, бета- та гамма - глобуліни. Гамма - глобуліни виявились найменш рухливими в електричному полі і залишались майже на старті. Після імунізації тварини зростав пік гамма-глобулінів в її сироватці, а після виснаження імунної сироватки антигеном він знову знижувався до рівня інтактних тварин (рис.). Отже, антитіла - це гамма - глобуліни. Щоб підкреслити роль антитіл в імунних реакціях, їх стали називати імуноглобулінами.
 |
Перші ж дані, що характеризували антитіла, було представлено в роботах Еміля фон Беринга і Кітазато, які в 1890 р. продемонстрували, що сироватка від мишей, які попередньо були імунізовані токсином правцю, при введенні інтактним тваринам захищає останніх від загибелі при дії смертельної дози токсину. Таким чином, утворений в результаті імунізації сироватковий фактор –антитоксин, - був першим відкритим вченими антитілом.
Вивченню структури антитіл сприяло використання так званих мієломних імуноглобулінів. Було встановлено, що у хворих з пухлинами лімфатичної системи (мієломи- злоякісні захворювання, при яких вибірково розмножуються В лімфоцити однієї специфічності, утворюючи клон, приклад: пухлина кісткового мозку- множинна мієлома) накопичується велика кількість абсолютно однакових моноклональних антитіл (до 70 мг/мл сироватки) чи їх фрагментів. Так, білки Бенс - Джонса, які секретуються у сечу хворих на множинну мієлому- це легкі ланцюги імуноглобулінів.
В 1972 році Едельман і Портер отримали Нобелівську премію за вивчення структури антитіл.
Сьогодні можна дати таке визначення антитіла (імуноглобуліну ) - це продуковані В-лімфоцитами глікопротеїни гамма-глобулінової фракції плазми крові вищих тварин і людини, які здатні специфічно взаємодіяти з антигеном.
Нагадаю, що структурна організація білків (за Шульцем Г., Ширмером Р.) складається з 6 рівнів.
Первинна структура – пептидний зв’язок.
Вторинна структура- 1- α-спіраль; β - структура; 2- водневі зв'язки.
Супер(над)вторинна - “цинковий палець” = Zinc Finger Motifs; спіраль-поворот-спіраль; “Лейцинова застібка” = Leucine Zipper і т.д.
Доменна організація – виокремлені функційні області (часто це - ділянка поліпептидного ланцюга, яка в процесі формування просторової структури незалежно від інших частин ланцюга, набула глобулярної конформації).
Третинна структура - водневі, іонні, гідрофобні, ковалентні (дисульфідні) та Ван-дер-Ваальсові взаємодії.
Четвертинна структура. Є ряд білків, до складу яких входять 2 та більше поліпептидних ланцюга, що після формування їх третинної структури можуть об’єднуватись з залученням гідрофобних, іонних та водневих зв’язків. Окремі поліпептидні ланцюги в цих білках - протомери, чи субодиниці, а їх взаємне розташування в просторі - четвертинна структура білка. Таким чином до складу олігомерного білка входять декілька протомерів.
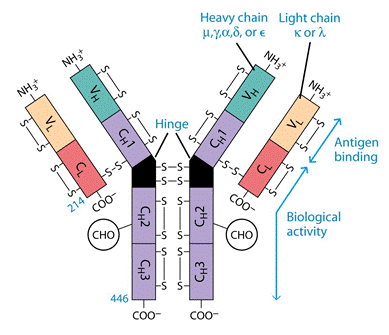
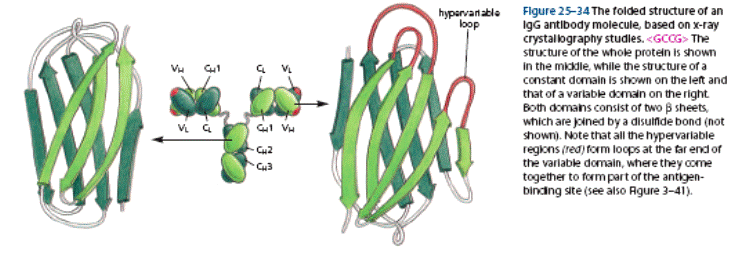
Молекула антитіла складається із двох типів поліпептидних ланцюгів: важких (Н) і легких (L) (слайд 6). Первинна структура- важкий ланцюг складається із 440-450 амінокислотних залишків (μ–ланцюг та ε мають на 100 залишків більше) і має молекулярну масу близько 50 кДа, а легкий ланцюг складається із 220-230 амінокислотних залишків і має молекулярну масу близько 25 кДа.
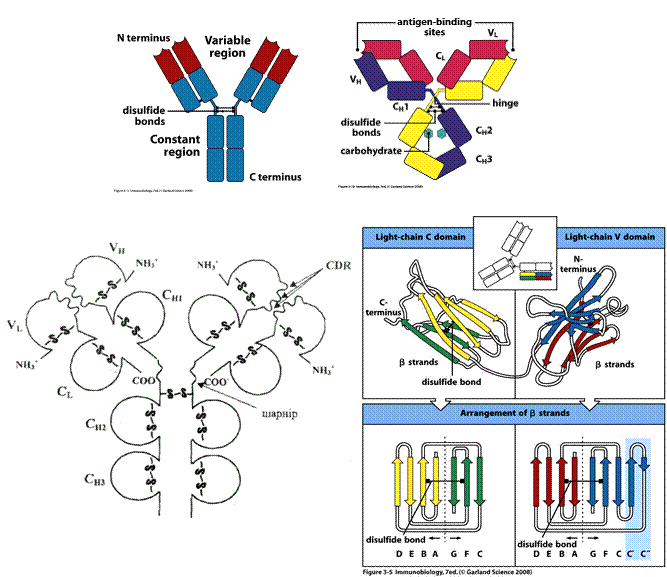
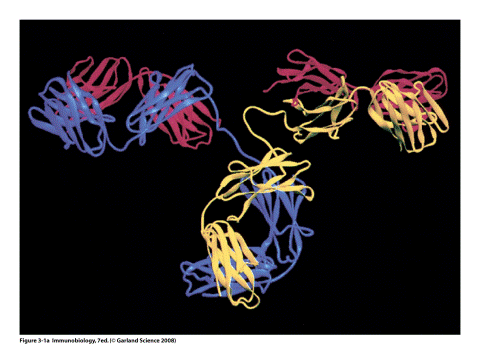 Вторинна структура імуноглобулінів - переважно антипаралельна β -складка, спіралізованих ділянок майже немає (слайд 7). Доменна організація - гнучкість фрагментів відносно осі молекули та специфічна будова центру, що зв'язує антиген (слайд 8). У третинній структурі - типовий рівень організації. Четвертинна структура -антитіла – білки, до складу яких входять 4 поліпептидні ланцюги, 2 з яких є ідентичними важкими (Н), 2 – ідентичними легкими (L) ланцюгами. Ланцюги з'єднані між собою міжланцюговими дисульфідними зв'язками (Н-Н та Н- L). (Слайд 6,7,8,9).
Вторинна структура імуноглобулінів - переважно антипаралельна β -складка, спіралізованих ділянок майже немає (слайд 7). Доменна організація - гнучкість фрагментів відносно осі молекули та специфічна будова центру, що зв'язує антиген (слайд 8). У третинній структурі - типовий рівень організації. Четвертинна структура -антитіла – білки, до складу яких входять 4 поліпептидні ланцюги, 2 з яких є ідентичними важкими (Н), 2 – ідентичними легкими (L) ланцюгами. Ланцюги з'єднані між собою міжланцюговими дисульфідними зв'язками (Н-Н та Н- L). (Слайд 6,7,8,9).
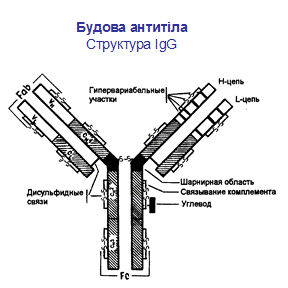

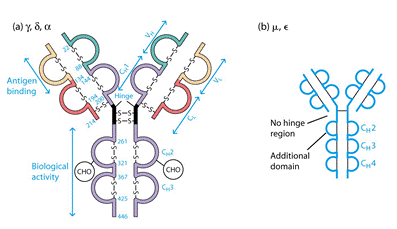

Важкі ланцюги поділяють на класи: α, μ, γ, δ, ε, - і відповідно розрізняють п'ять класів (ізотипів) імуноглобулінів: ІgА, ІgМ, ІgG, ІgD, ІgЕ. Для легких ланцюгів виділяють типи k і λ; k зустрічаються частіше, ніж λ. У структурі молекули імуноглобуліну міститься два важких і легких ланцюга. Підкласиважких ланцюгів (у людини): 4γ (γ1, γ2, γЗ і γ4),2μ (μ1 і μ2), 2α (α1 і α2), 1ε і 1δ. Підтипи легких ланцюгів: 1κ, 4λ (+λ5, що експресується в ембріональному стані). (Табл.1).
Табл. 1. Будова молекули антитіла

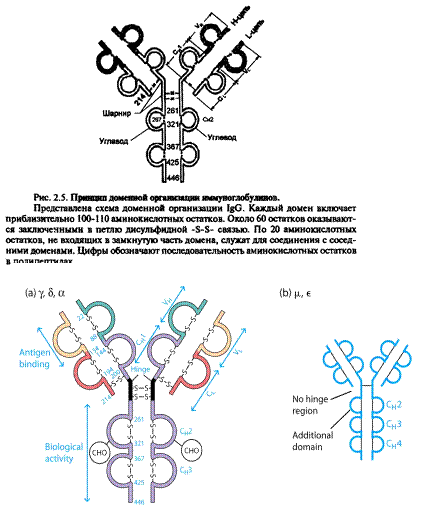
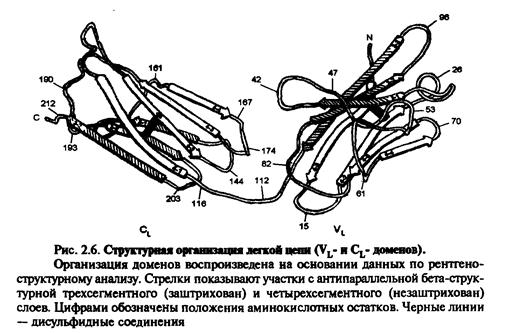
Імуноглобуліни характеризується вираженою доменністю, що структурується внутрішньоланцюговими дисульфідними зв'язками. Саме вони замикають домени(приблизно по 60-70 амінокислотних залишків), їх два у легкому ланцюгу і чотири у важкому (п'ять у ε- та μ-ланцюгу). Справа і зліва знаходяться приблизно по 20 а.з., які не входять в структуру домену, а слугують для з'єднання з сусідніми доменами.До складу доменів входять 2 β шари, які містять атипаралельні 3-х та 4-х сегменті β-складки, що структуровані дисульфідними містками (вторинна структура). Фактично утворюється структура, що нагадує діжку.
Рис.2. Принцип доменної організації іммуноглобулінів
 | |||
 |
 | |||||
 | |||||
 |
Читайте також:
- C. 3. Структурна побудова управління організаціями.
- II. Будова доменної печі (ДП) і її робота
- А) Товар і його властивості.
- Алкани, їх хімічні властивості.
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Анатомічна будова кістки
- Анатомічна будова кісток вільної нижньої кінцівки
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка та її вплив на його психологічні особливості й поведінку.
- Антигенна будова HDV
| <== попередня сторінка | | | наступна сторінка ==> |
| СИТУАЦІЙНІ ЗАДАЧІ. | | | Типова молекула імуноглобуліну. Виділено структурну організацію легкого ланцюга імуноглобуліну |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |