
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
СТИСЛИЙ конспект лекцІй
Щоб зіткнення частинок дійсно привели до хімічного перетворення, оскільки ефективні не всі зіткнення, а тільки ті, в яких беруть участь “активні” молекули, що мають енергію, більшу за Еа.
Проілюструємо важливість цього положення
простим розрахунком. Константа швидкості реакції
2HI 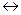 I2 + H2
I2 + H2
при 1000С дорівнює k = 8,83 × 10-16 (моль/л)-1×с-1. Щоб зробити наявним це значення k, розрахуємо час напівперетворення для цієї реакції другого порядку
(див. 9.3) при С0 = 1 моль/л:
t1/2 =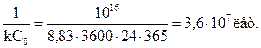
Таким чином, при 1000С половина вихідного йодистого водню розклалася б за 36 мільйонів років. Причина цього у тому, що за даної температури дуже мала частка активних молекул. Табл. 10.1 ілюструє залежність частки активних молекул від температури для різних значень енергії активації.
Чим більші значення Еа, тим сильніше швидкість реакції залежить від температури. Однак якщо частка активних молекул більша за 10-7, то така реакція проходить дуже швидко (вибух), а якщо менша за 10-18 , то реакція проходить дуже повільно.
Таблиця 10.1 - Частка активних молекул
| Т, К | Енергія активації, Еа, Кдж/моль | |||
| 0,13 0,37 0,55 0,67 | 2×10-9 4×10-5 2×10-3 2×10-2 | 4×10-18 2×10-9 6×10-6 3×10-4 | 8×10-27 9×10-14 1×10-8 6×10-6 |
Досвід показує, що не всі зіткнення активних молекул приводять до хімічних перетворень. Теорія активних зіткнень пояснює це тим, що
3) взаємодіючі молекули при зіткненні повинні бути певним чином зорієнтовані у просторі, тобто повинні утворювати конфігурацію, яка найбільш придатна для розриву одних зв’язків та виникнення інших.
Рівняння Арреніуса набирає вигляду
k = A × P e-Еа/RT, (10.23)
де Р - стеричний множник, який визначає просторову орієнтацію взаємодіючих молекул ( Р £ 1); А - стала ( А×Р= =k0). Було наведено, що Р = ехр (Sa/R), де Sa - ентропія активації. Тому
k = Z × e-Ea/RT × eSa/R, (10.24)
де Z - стала. Отже, можна казати про ентальпійний (exp[-Ea/RT]) та ентропійний (exp Sa/R) чинники. Проте ентропійний чинник не залежить від температури. Його роль особливо помітна для реакцій, в яких беруть участь складні молекули, взаємна орієнтація яких повинна бути такою, щоб одна до одної підходили певні ділянки взаємодіючих молекул. Наприклад, для реакції
Н2 + І2  2HI
2HI
P ~ 1, а для реакції
С2Н5І + (С2Н5)3N  (C2H5)4NI
(C2H5)4NI
P~ 10-6.
Для знаходження констант рівняння Арреніуса (10.22) дані визначення швидкості реакції при різних температурах подають у логарифмічному вигляді:
 (10.25)
(10.25)
Потім у координатах ln k - 1/T будують графік прямої (рис. 10.6), тангенс кута нахилу якої дорівнює -Еа/R, а відрізок , що відсікається продовженням прямої на осі ординат, дорівнює ln k0 (зручніше розрахувати рівняння цієї прямої на ЕОМ і отримати її коефіцієнти).
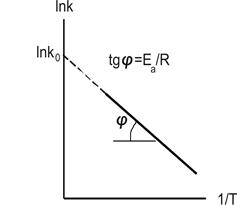
Рисунок10.6 Графічне визначення енергії активації
Слід зазначити, що хоча швидкість більшості реакцій підвищується із збільшенням температури, це підвищення не завжди монотонне й іноді на кривих залежності швидкості від температури спостерігаються максимуми або мінімуми. Це пов’язано із складним механізмом таких реакцій, наявністю каталізаторів та низкою інших причин.
Висновки
Розглянуто кінетика оборотних, паралельних і послідовних реакцій. Дано уявлення про розгалужені і нерозгалужені ланцюгові реакції. Сформульовано основи кінетики фотохімічних реакцій. Розглянуто механізм впливу температури на кінетику реакцій. Сформульовано основи теорії активних зіткнень.
При кінетичному вивченні складних реакцій використовують принцип незалежності, який є одним з постулатів хімічної кінетики. Він формулюється так:
Якщо у системі проходить декілька реакцій,
Читайте також:
- Види лекцій
- Викладення лекційного матеріалу
- ГИСТОЛОГИЯ. КОНСПЕКТ ЛЕКЦИЙ.
- Електронний конспект лекцій
- Завдання лекційних занять
- І. ПРОСЛУХОВУВАННЯ ТА КОНСПЕКТУВАННЯ ЛЕКЦІЙ
- ІІ. МАТЕРІАЛИ ДО КУРСУ ЛЕКЦІЙ
- ІІI. Тематика лекцій
- ІІІ. ПЛАН ПРОВЕДЕННЯ ЛЕКЦІЙНОГО ЗАНЯТТЯ
- Індивідуальний метод обліку кількості знесених яєць проводять у селекційних стадах, застосовують для цього контрольні гнізда, або утримання в індивідуальних клітках.
- Коновалова М.Д.Экспериментальная психология: конспект лекций. - Высшее образование. – 2006.
- КОНСПЕКТ
| <== попередня сторінка | | | наступна сторінка ==> |
| При підвищенні температури на 100 швидкість | | | Швидкістю найбільш повільної стадії. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |