
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Константа електролітичної дисоціації
Оскільки електрична дисоціація слабких електролітів являє собою оборотний процес, то вона підпорядковується закону діючих мас. Таким чином, для процесу дисоціації слабкого електроліту можна записати константу рівноваги. Як приклад розглянемо дисоціацію слабкого електроліту KA:
 .
.
Позначимо концентрацію іонів як [K+] та[A−], а концентрацію недисоційованих молекул через [KA]. Тоді константу рівноваги запишемо так:
 .
.
Константа рівноваги процесу дисоціації слабкого електроліту називаєтьсяконстантою дисоціації Кдис. Вона, як і ступінь дисоціації, є кількісною мірою можливості речовини дисоціювати в розчині. Чим менше значення Кдис, тим слабший електроліт і навпаки, чим більше Кдис, тим краще дисоціює розчинена речовина. Константа дисоціації не залежить від концентрації розчину, але залежить від температури. (Вона має розмірність концентрації - моль на літр.)
Із рівноваги слабкого електроліту  бачимо, що збільшення концентрації в розчині одного з іонів [K+] або [A−] внаслідок введення у розчин електроліту [KА] речовини, яка містить однойменний іон, зміщує рівновагу вліво (принцип Ле Шательє). Тому, якщо до розчину ацетатної кислоти додати розчин натрій ацетату, то концентрація молекул кислоти збільшиться. Розбавлення розчину слабкого електроліту сприяє дисоціації. Ступінь дисоціації при цьому збільшується, а значення константи дисоціації Кдисзалишається незмінним.
бачимо, що збільшення концентрації в розчині одного з іонів [K+] або [A−] внаслідок введення у розчин електроліту [KА] речовини, яка містить однойменний іон, зміщує рівновагу вліво (принцип Ле Шательє). Тому, якщо до розчину ацетатної кислоти додати розчин натрій ацетату, то концентрація молекул кислоти збільшиться. Розбавлення розчину слабкого електроліту сприяє дисоціації. Ступінь дисоціації при цьому збільшується, а значення константи дисоціації Кдисзалишається незмінним.
Слабкі електроліти, які складаються більше ніж із двох іонів, дисоціюють ступінчасто. Кожен ступінь дисоціації характеризується певною величиною константи дисоціації. Ці константи дисоціації називаються ступінчастими і позначаються К1, К2, …Кn. Прикладом багатоіонного електроліту є ортофосфатна кислота H3PO4. Відповідно до послідовного відщеплення іонів гідрогену можна записати три рівняння рівноваги, які характеризуються ступінчастими константами дисоціації. При цьому практично завжди К1 > К2 >…> Кn, оскільки енергія відщеплення першого іона від нейтральної молекули завжди менша:
 ;
;
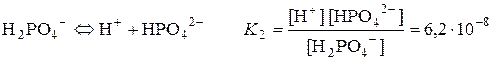 ;
;
 .
.
К1 > К2 > К3.
Сумарна константа дисоціації

дорівнює добутку ступінчастих констант дисоціації:
 .
.
Ступінчасто дисоціюють також багатокислотні основи та амфотерні гідроксиди, наприклад:
Pb(OH)2 Û PbOH+ + OH−,
PbOH+ Û Pb2+ + OH−.
Закон розведення.Між константою та ступенем електролітичної дисоціації існує взаємозв’язок, який називається законом розведення Оствальда. Запишемо рівняння дисоціації слабкого бінарного електроліту типу КА:
 .
.
Нехай його концентрація [KА]0 дорівнює С моль/л, а ступінь дисоціації a. Тоді концентрація іонів
[KA]х = [K+] = [A−] =Сa,
а концентрація недисоційованих молекул дорівнює
[KА] = С(1-a).
Якщо підставити значення концентрацій усіх частинок електроліту у вираз його константи дисоціації, одержимо
 , або
, або  −
−
це рівняння є математичним вираженням закону розведення Оствальда.
Якщо електроліт дуже слабкий, тобто a < 0,1, то рівняння спрощується:
 ,
,
звідси
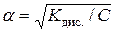 .
.
Із цього рівняння випливає важливий висновок: зі зменшенням
концентрації електроліту ступінь його дисоціації зростає.
Читайте також:
- Взаємодія йонів солі, що утворюються в результаті електролітичної дисоціації з молекулами води, називається гідролізом солі.
- Константа електролітичної дисоціації
- Константа кондуктометричної чарунки
- Константа хімічної рівноваги
- Константа хімічної рівноваги. Рівняння ізотерми хімічної реакції
- Константа швидкості реакції в гомогенній системі та гетерогенній.
- Конфлікт як константа педагогічного соціуму, ставлення до нього у різних педагогічних парадигмах
- Крива дисоціації оксигемоглобіну, фактори, що впливають на її хід.
- Ступінь електролітичної дисоціації
- Ступінь електролітичної дисоціації. Здатність електроліту дисоціювати на іони кількісно оцінюють за допомогою ступеня дисоціації б.
- ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
| <== попередня сторінка | | | наступна сторінка ==> |
| Реакції в розчинах електролітів. Іонні рівняння | | | Властивості розчинів сильних електролітів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |