
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Добуток розчинності
Якщо кристали малорозчинної солі побудовані з іонів, то в розчин переходять не молекули, а іони солі. Для малорозчинної сполуки, наприклад BaSO4 або AgCl, яка знаходиться в рівновазі зі своїм насиченим розчином, рівняння динамічної рівноваги має такий вигляд:
BaSO4 Û Ba2+ + SO42-,
Тверда фаза Насичений розчин
тобто за постійної температури за одиницю часу в розчин переходить така кількість солі, яка за цей же час із розчину випадає в осад (тверду фазу). Оскільки числове значення знаменника у виразі константи рівноваги дорівнюватиме 1 (для чистої твердої речовини), для наведеного вище зворотного процесу за постійної температури
[Ba2+]∙[SO42-] = K,
де К – константа рівноваги між малорозчинною сполукою та її іонами
в розчині.
Із рівняння випливає, що в насиченому за певної температури розчині добуток концентрацій іонів малорозчинного електроліту являє собою сталу величину, яка називається добутком розчинності і позначається ДР. Тоді для насиченого розчину BaSO4 (при 250) запишемо так:
ДР(BaSO4) = [Ba2+]∙[SO42-]=1∙10-10.
У загальному вигляді вираз добутку розчинності насиченого розчину малорозчинної речовини KxAy, яка розпадається на іони за рівнянням
KxAy Û xKy+ + yAx-,
буде мати такий вигляд:
ДР(KxAy) = [Ky+]x∙[Ax-]y.
Наприклад, для малорозчинних у воді солей Ag2S та Ba3(PO4)2 маємо:
 ,
,
 .
.
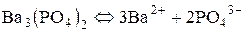 ,
,
 .
.
Виходячи з добутків розчинності (табличних даних) можна розрахувати розчинність різних важкорозчинних сполук і навпаки.
Наприклад:  ,
,
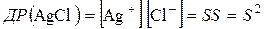
або 
Оскільки ДР сполуки за певної температури є сталою величиною, то збільшення концентрації в розчині одного з іонів, на які дисоціює дана сполука, обумовлює зменшення концентрації іншого. Так, якщо до насиченого розчину  додати розчин сполуки, яка містить іон
додати розчин сполуки, яка містить іон  , то рівновага порушиться і відповідно до принципу Ле Шателье зміститься вліво, тобто в осад почне випадати
, то рівновага порушиться і відповідно до принципу Ле Шателье зміститься вліво, тобто в осад почне випадати  . Те саме відбувається в разі введення в насичений розчин
. Те саме відбувається в разі введення в насичений розчин  надлишку іонів барію.
надлишку іонів барію.
Таким чином, введення однойменних іонів у розчин малорозчинного електроліту зменшує його розчинність(це відбувається до певної межі, оскільки надлишок однойменного іона кількістю, що перебільшує 50%, починає сприяти розчиненню). Цей висновок має велике практичне значення, зокрема в кількісному аналізі, оскільки дає можливість практично повністю осаджувати той чи інший іон у вигляді малорозчинної сполуки.
Читайте також:
- В) добуток синусів і косинусів.
- Векторний добуток векторів
- Векторний добуток векторів.
- Векторний добуток і його властивості.
- Визначення розчинності
- Вуглевидобуток в Україні та перспективи його розвитку
- Де - місячний видобуток руди у кар’єрі, млн.т.
- Декартів добуток
- Декартів добуток двох множин. Зображення декартового добутку двох числових множин на координатній площині
- Декартовий (прямий) добуток множин
- Дисоціація води. Іонний добуток води. Водневий показник
- Дисоціація води. Йонний добуток води
| <== попередня сторінка | | | наступна сторінка ==> |
| Властивості розчинів сильних електролітів | | | Дисоціація води. Іонний добуток води. Водневий показник |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |