
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Типи міжатомних зв'язків у твердих тілах
Електронна будова атомів, які взаємодіють між собою, визначаєтип зв'язкуміж елементарними частинками в твердому тілі (кристалі). Тип зв'язку істотно впливає на властивості матеріалу. Найважливішими зв'язками є іонний, ковалентний і металевий.
Іонний зв'язок виникає між різнорідними атомами, наприклад натрію і хлору, один з яких віддає свій валентний електрон і перетворюється у позитивно заряджений іон (Na+), а інший приймає електрон і стає негативно зарядженим іоном (Сl-). Отже, іонний зв'язок зумовлюється електростатичною взаємодією протилежно заряджених іонів. Він типовий для неорганічних сполук. У більшості випадків іонні кристали є діелектриками.
Ковалентний зв'язок утворюється за рахунок об'єднання валентних електронів сусідніх атомів на одному енергетичному рівні. Об'єднані електрони належать водночас обом атомам і перебувають на спільному рівні. Ці електрони мають протилежно скеровані спіни і взаємодіють як два електромагніти. Ковалентний зв'язок утворюють як однорідні атоми (кремній, вуглець в кристалічній ґратці алмазу), так і різнорідні (залізо – вуглець у хімічній сполуці Fе3С, алюміній - азот у хімічній сполуці АlN). Ковалентний зв'язок дуже міцний. Багато кристалів з таким зв'язком мають високу температуру плавлення, велику твердість (карбіди, нітриди) і стійкість до зношення.
Властивості металів характерні для металевого стану речовини, основною з яких є наявність вільних електронів. Металевий стан виникає при зближенні атомів. При цьому зовнішні електрони втрачають зв'язок з окремими атомами, стають загальними (колективізуються) і вільно переміщаються по визначених енергетичних рівнях між позитивно зарядженими періодично розташованими в просторі іонами. Електростатична взаємодія між позитивно зарядженими іонами та негативно зарядженими вільними електронами утворює металевий зв'язок. Валентні електрони атомів металу порівняно легко втрачають зв'язок зі своїми ядрами, утворюючи так званий електронний газ.
Металевий зв'язок не скерований в одному напрямку, а його сила визначається співвідношенням між силами відштовхування і силами тяжіння між іонами й електронами. Атоми (іони) розташовуються на такій відстані один від іншого, щоб енергія взаємодії була мінімальною (рис.1.1). Цьому становищу відповідає рівноважна відстань Ro. Зближення атомів (іонів) на відстань менше Ro або віддалення їх на відстань більше Ro можна здійснити лише при вчиненні певної роботи проти сил відштовхування чи притягування. При закономірному розташуванні атомів у металі з утворенням правильної кристалічної гратки буде реалізований стан з мінімальною енергією взаємодії атомів.
Атоми (іони) займають положення з мінімальною потенційною енергією. Атоми, які складають поверхневий шар, мають підвищену потенційну енергію за рахунок наявності некомпенсованих сил взаємодії (приймаючи сферичний характер силового поля навколо атома (іона)).
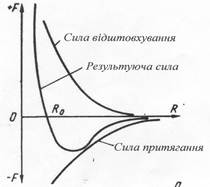
Рис.1.1. Сили взаємодії двох атомів
| <== попередня сторінка | | | наступна сторінка ==> |
| Електронна будова атома | | | Атомно-кристалічна структура металів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |