
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема 4. Хімічний зв'язок
Хімічний зв'язок - взаємодія двох або кількох атомів, внаслідок якої утворюється хімічно стійка дво- або богатоатомна система (молекула чи кристал).
Природа хімічного зв’язку полягає в притягуванні позитивно заряджених ядер до негативно зарядженої області перекривання електроних орбіталей, що приводить до загального зниження енергії системи.
Основні типи хімічного зв’язку: ковалентний, йонний, металічний, водневий.
Ковалентний зв'язок утворюється за допомогою спільних електронних пар. Механізми утворення: електронно-обмінний (звичайний) та донорно-акцепторний. За електронно-обмінним механізмом спільна електронна пара утворюється при перекриванні одноелектронних атомних орбіталей, що містять по одному електрону з антипаралельними спінами (рис.4).

Рис.4. Утворення ковалентного зв’язку під час перекривання s і p–орбіталей.
За донорно – акцепторним механізмом спільна електронна пара утворюється при перекриванні електронної орбіталі, що містить неподільну електрону пару з вільною (вакантною) орбіталлю іншого атома.
При утворенні ковалентного зв’язку можуть приймати участь електрони різних орбіталей (s, p, d, f), що мають різноманітну форму та орієнтацію в просторі. В багатьох сполуках при перекриванні орбіталей різної форми утворюються рівноцінні зв’язки. Для пояснення цього явища запроваджено поняття «гібридизація». Гібридизація – це процес змішування та вирівнювання орбіталей за формою та енергією. Основні типи гібридизації – sp, sp2 та sp3. Схеми їх утворення приведені на рис. 5–7.

Рис.5. sp- гібридизація
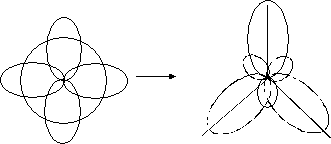
Рис.6. sp2- гібридизація.
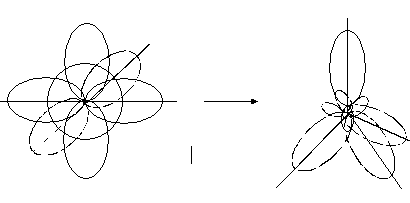
Рис.7. sp3- гібридизація.
Основні характериcтики ковалентного зв'язку: напрямленість, кратність, насиченість, здатність до поляризації, довжина та енергія.
Напрямленість обумовлена тим, що атомні орбіталі мають свою форму та орієнтацію у просторі, а їх взаємодія відбувається в напрямку максимального перекривання. В залежності від напрямку перекривання розрізняють s і p зв'язки. s - зв'язок утворюється, коли атомні орбіталі перекриваються вздовж осі, що з'єднує ядра атомів (Рис.8):
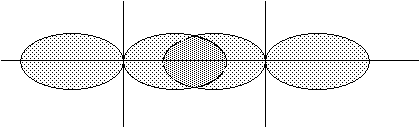
Рис. 8. Схема утворення s - зв'язку.
p - зв'язок утворюється, коли області перекривання розташовані по різні сторони від осі, що з'єднує ядра атомів (рис.9).
Насиченість ковалентного зв'язку обумовлена тим, що кожний атом має визначену кількість атомних орбіталей, які можуть приймати участь в утворенні хімічного зв'язку.

Рис.9. Схема утворення p - зв'язку.
Полярність зв'язку виникає, коли центри позитивного і негативного зарядів в молекулі не співпадають. При цьому виникає диполь. Полярний зв'язок утворюється тоді, коли молекулу утворюють різні атоми. В випадку однакових атомів утворюється ковалентний неполярний зв'язок
Енергія зв'язку це енергія, яка потрібна для розриву цього зв'язку.
Кратність зв'язку визначається кількістью хімічних зв'язків, що з'єднують два атома. Бувають ординарний, подвійний та потрійний зв'язки. В хімії широко застосовується поняття – валентність. Валентність атома – це його здатність утворювати певне число хімічних зв'язків з іншими атомами.
Йонний зв'язок - утворюється за рахунок електростатичного тяжіння йонів. Його можна розглядати як граничний випадок ковалентного полярного зв'язку, який утворюється в разі великої різниці в електронегативностях атомів, що утворюють зв’язок. Типовими йонними сполуками є галогеніди та оксиди лужних металів. Всі йонні сполуки у твердому стані є кристалічними речовинами – у вузлах кристалічних решіток (граток) знаходяться позитивно і негативно заряджені йони (рис.10):
Решітка NaCl Решітка СsCl

|
Рис. 10. Кристалічні решітки NaCl i CsCl.
Металічний зв'язок - утворюється за допомогою електронів, спільних для всіх позитивно заряджених йонів, що утворюють кристалічну гратку. Валентні електрони в металах є усуспільненими і належать всьому кристалу, тобто утворюють електронний газ. При накладанні електричного поля ці електрони дуже легко пересуваються. Це пояснює високу електропровідність більшості металів.
Міжмолекулярні зв’язки - це зв’язки між електронейтральними молекулами, які мають електричну природу. Енергія міжмолекулярної взаємодії значно менша ніж енергія звичайного хімічного зв’язку. Одним з різновидів міжмолекулярного зв’язку є водневий зв’язок. Водневий зв’язок виникає між молекулами, до складу яких входять атоми водню та іншого елемента з високою електронегативністю (F, O, Cl, N). Найбільш сильний водневий зв'язок виникає між молекулами НF. Графічно він позначається ( ¼ ). Наприклад: H–F ¼ H–F.
Приклад 9.
Визначити тип хімічного зв'язку в таких сполуках: (O2, H2O, NaCl, CaO, NO2, HF, N2,, P2O5, H2). Для простих речовин визначити кратність зв'язку.
Розв'язання.
(O2) — ковалентний неполярний (подвійний зв'язок.); (H2O) — ковалентний полярний + водневий ; (NaCl) – йонний; (CaO) – йонний , (NO2) – ковалентний полярний; (HF) — ковалентний полярний + водневий; (N2) — ковалентний неполярний (потрійний зв'язок); (P2O5) — ковалентний полярний.; (H2)— ковалентний неполярний (ординарний зв'язок).
Приклад 10.
Який тип гібридизації атомних орбіталей атома Карбону в молекулі Н2С=СН2?
Розв'язання.
В молекулі Н2С=СН2 кожен атом Карбону утворює три s–зв’язки (один з іншим актомом Карбону, два інших – з двома атомами гідрогену) та один p–зв’язок (з атомом Карбону). Тому тип гібридизації атомних орбіталей Карбону sp2.
Запитання для самоконтролю
1. Які є найважливіші типи хімічного зв'язку?
2. В якому випадку утворюється йонíий зв'язок?
3. Що таке валентність і ступінь окиснення?
4. Які основні характеристики й властивості ковалентного зв'язку?
5. Чим визначається полярність ковалентного зв'язку?
6. Для чого введено поняття гібридизації орбіталей?
7. Чим відрізняються аморфні і кристалічні речовини?
8. Що таке кристалічні гратки?
9. Наведить приклади багатоцентрового хімічного зв'язку?
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 3. Періодичний закон | | | РОЗДІЛ 2. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ХІМІЧНИХ ПРОЦЕСІВ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |