
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Методи визначення концентрації
1) Метод градуювального графіка (графічний метод) Готують серію стандартних розчинів з відомою концентрацією визначуваної речовини і вимірюють їх оптичну густину при певній довжині хвилі. За отриманими даними будують градуювальний графік в координатах А–С(m) (рис. 1.4). До досліджуваного розчину додають таку ж кількість реактивів що і до стандартних і вимірюють його оптичну густину і за градуювальним графіком знаходять вміст визначуваної речовини.
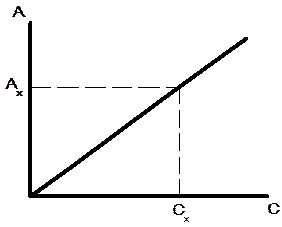
Рис. 1.4 Градуювальний графік в прямій фотометрії
Підпорядкування закону Бера не є строго необхідною умовою для цього методу. Якщо для досліджуваних у визначених умовах речовин, установлені відповідна залежність А від С, що представляє криву, а не пряму, то вона може служити калібрувальним графіком, але для її побудови необхідно більше еталонних розчинів.
2) Метод молярного коефіцієнта світлопоглинання–полягає в вимірюванні оптичної густини декількох стандартних розчинів. Для кожного розраховують ε: ε= 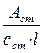 і знаходять середнє значення εср. Визначивши Aх, знаходять його концентрацію:
і знаходять середнє значення εср. Визначивши Aх, знаходять його концентрацію:
сx = 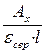 .
.
В цьому методі необхідно знати точні значення молярного коефіцієнта поглинання в реальних умовах, тому метод використовується рідко.
3) Метод стандартів. Готують один стандартний розчин і вимірюють оптичну густину стандартного Аст та досліджуваного Aх розчинів. сх знаходять за пропорцією:
Aст = εсстl Aх = εсхl,
Aст/Aх = сст/сх звідки 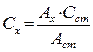 .
.
(Необхідне підпорядкування закону Бугера-Ламберта-Бера).
4) Метод добавок. У дві мірні колби відбирають певний об'єм розчину досліджуваної речовини. В одну з цих колб додають стандартний розчин. Після переведення компонента в забарвлену сполуку, об'єми розчинів в колбах доводять до мітки фоном і вимірюють оптичну густину цих розчинів. Метод дозволяє аналізувати складні суміші.
Aх = εсхl,
Aх+ст = ε(сх + сст)l,
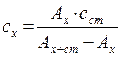 .
.
5) Диференційний методполягає у вимірюванні оптичної густини розчину, що аналізують, не по відношенню до води (розчинника), а відносно до стандартного розчину визначуваної речовини з відомою концентрацією. При цьому вимірюють відносну оптичну густину ∆А.
Рис. 1.5 Градуювальний графік в диференційній фотометрії

Aх = εсхl,
Aст = εсстl,
∆А = Aх – Aст = el(cx–cст),
де Aст – оптична густина стандартного розчину відомої концентрації.
Використовуючи набір еталонних розчинів, будують калібрувальний графік в координатах ∆А–с (концентрація). Вимірюють ∆А розчину, що аналізується і по графіку знаходять його концентрацію (рис. 1.5).
Цей метод застосовують:
а) при визначенні більш високих концентрацій речовини;
б) для усунення впливу сторонніх компонентів, які заважають визначенню та які вводять у розчин порівняння;
в) для виключення помилки за рахунок поглинання світла самим реактивом.
6) Метод фотометричного титрування. В цьому методі, розчин, який містить визначувану речовину, в прозорій посудині поміщують на шляху світлового потоку, додають титрант порціями при перемішуванні і вимірюють оптичну густину при обраній довжині хвилі після кожного додавання титранта. За отриманими даними будують графік в координатах А–VR (мл) (рис. 1.6). Графічно знаходять точку еквівалентності як точку перетину двох лінійних ділянок і визначають об’єм титранта, що пішов на титрування, та розраховують вміст речовини X, що визначається.

Рис. 1.6 Крива фотометричного титрування
Х + R ↔ ХR 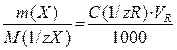 .
.
Форма кривих фотометричного титрування залежить від того які речовини поглинають електромагнітне випромінювання з обраною довжиною хвилі: визначувана речовина, продукт реакції чи титрант.
| <== попередня сторінка | | | наступна сторінка ==> |
| Фотометричний метод аналізу | | | Вимірювання інтенсивності світлопоглинання |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |