
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Визначення заліза(Ш) із сульфосаліциловою кислотою диференційним методом
Метод заснований на утворенні забарвлених комплексів заліза(III) із сульфосаліциловою кислотою (H2SSal–). Залежно від рН розчину можливе утворення трьох комплексів різного складу, що мають різну стійкість і забарвлення: моно-, ди- і трисульфосаліцилат заліза. Відповідні реакції комплексоутворення можна представити наступними умовними схемами.
При рН<3:
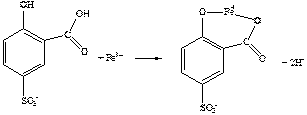
[FeSSal] – фіолетовий; Кстійк.=1017; lmax=510 нм.
У слабокислих і слаболужних розчинах, рН = 4 – 9:
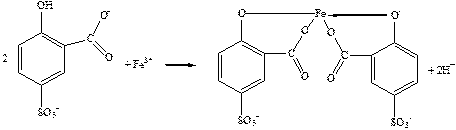
[Fe(SSal)2]3– – червоний; Кстійк.=1027; lmax=480 нм.
При рН=9–12:

[Fe(SSal)3]6– – жовтий; Кстійк.=1034; lmax=420 нм.
При рН>12 відбувається розкладання комплексу з виділенням в осад гідроксиду заліза.
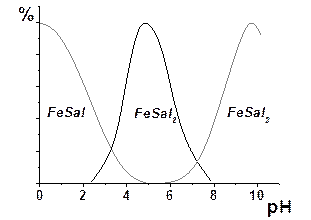
Оскільки вихід комплексних форм залежить від рН розчину (рис. 1.8), то реакції необхідно проводити в строго визначеному інтервалі кислотності, який відповідає максимальному виходу індивідуальної комплексної сполуки.
| 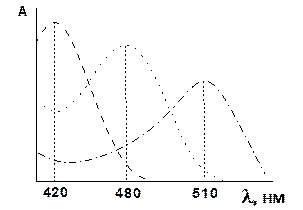
|
| Рис. 1.8 Залежність виходу комплексів у системі Fe3+–H2SSal– від рН розчину | Рис. 1.9 Спектри поглинання комплексних сполук |
Залізо(ІІІ) як d-елемент з повністю заповненим d-рівнем має хромофорну дію, тому для його визначення можна використовувати незабарвлені реагенти, до числа яких і відноситься сульфосаліцилова кислота. Забарвлення сульфосаліцилату заліза обумовлене переходом електронів з орбіталей, локалізованих на ліганді, на орбіталі, локалізовані на атомі металу.
З рис. 1.9 видно, що максимум поглинання моносульфосаліцилату заліза(ІІІ) знаходиться при 510 нм і визначення заліза(III) виконують, використовуючи зелений світлофільтр. Жовтий комплекс трисульфосаліцилату заліза [Fe(SSal)3]6– варто визначати використовуючи фіолетовий світлофільтр.
Сульфосаліцилатні комплекси більш стійкі, ніж роданідні, що дозволяє широко використовувати їх в аналізах для визначення заліза в присутності хлоридів, фосфатів, ацетатів і боратів. Визначенню заліза(ІІІ) у вигляді сульфосаліцилатного комплексу не заважають елементи, що утворюють безбарвні комплекси з цією кислотою, наприклад, Ві(ІІІ); Іn(III); Ga(III); Zr(IV); Hf(IV); Th(IV) при великому надлишку реагенту. Комплекси міді та алюмінію в кислому середовищі менш стійкі, ніж комплекси заліза(III), тому вони теж не заважають визначенню.
Необхідні прилади і реактиви:
1. Фотоколориметр і кювети.
2. Мірні колби місткістю 50 мл – 6 шт.
3. Стандартний розчин заліза, що містить 0,1 мг Fe у 1 мл.
4. Сульфосаліцилова кислота, 10%-вий розчин.
5. Сульфатна кислота – 1М розчин.
Методика роботи
1) Приготування серії стандартних розчинів. У мірні колби місткістю 50 мл з бюретки відміряють 2,5 мл, 5 мл, 7,5 мл, 10 мл і 12,5 мл стандартного розчину заліза, додають по 10 мл сульфосаліцилової кислоти, по 10 краплин 1М сульфатної кислоти і доводять об'єми рідини в колбах до мітки дистильованою водою.
2) Побудова калібрувального графіка. Для побудови калібрувального графіка вимірюють оптичну густину приготовленої серії стандартних розчинів відносно розчину №3 (з середньою концентрацією) при l=540 нм. Так як фотометричні прилади не пристосовані для виміру негативних значень, тому при вимірюванні відносних оптичних густин менш забарвлених розчинів (№ 1, 2) відносно більш забарвленого (№3) компенсацію проводять на досліджуваному розчині, а отримане значення DА записують з «–». Отримані дані заносять в таблицю 1.4 і будують калібрований графік, використовуючи як позитивну, так і негативну частину.
3) Визначення вмісту заліза в задачі. Розчин контрольної задачі готують так само як і стандартні, вимірюють його оптичну густину відносно розчину №3 і за графіком знаходять відповідну їй концентрацію.
Таблиця 1.4
Результати визначення заліза(ІІІ) з сульфосаліциловою кислотою
| № п/п | Стандартний р-н Fe3+, мл | Вміст Fe3+, мг | DА | DА (задача) | m (Fe), мг |
| 2,5 | 0,25 | ||||
| 5,0 | 0,50 | ||||
| 7,5 | 0,75 | ||||
| 10,0 | 1,00 | ||||
| 12,5 | 12,50 |
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Рефрактометричний аналІз |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |