
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Протолітичні рівноваги в розчинах кислот та основ
У практиці аналітичної хімії найчастіше мають справи з водними розчинами кислот, основ чи солей, які є електролітами. У водних розчинах на поведінку кислот і основ впливає іонізація (автопротоліз) води:
Н2О ↔ Н+ + ОН- або Н2О + Н2О↔ Н3О+ + ОН-
Кw = [Н+][ ОН-]= 1 10-14 – іонний добуток води за 25 0С.
У чистій воді [Н+] = [ ОН-]= 1 10-7 моль/дм3 ; -lg[H+] = - lg[OH-] = -lg 10-7=7;
Концентрація іонів гідрогену у розчині характеризує його кислотність. Кислотність середовища позначають водневим показником рН.
рН = -lg[H+]; рОН = - lg[OH-].
Для води і розбавлених водних розчинів виконується рівність:
рН + рОН = 14.
У розведених водних розчинах сильних одноосновних кислот і речовин, водні розчини яких мають властивості сильних кислот, рівноважна молярна концентрація Н+ - іонів дорівнює молярній концентрації кислоти: [H+] = c(НА).
рН = -lg[H+]=-lg c(НА).
У розведених водних розчинах сильних основ рівноважна молярна концентрація ОН- - іонів дорівнює молярній концентрації сильної основи:
[ОН-] = c(KtOH). рОН = - lg[OH-] =-lg c(KtOH).
рН = 14 - рОН = 14 + lg c(KtOH) .
Реакції у водних розчинах слабких кислот і основ – це реакції між іонами. Будучи оборотним, процес дисоціації слабких кислот і основ характеризується константою рівноваги (константою дисоціації або іонізації). Наприклад, константа електролітичної дисоціації ацетатної кислоти:
CH3COOH = H+ + CH3COO-
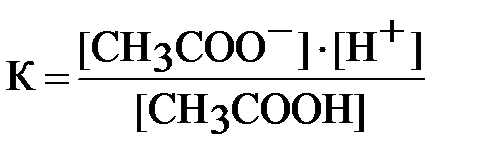 ,
,
де [H+] i [CH3COO-] – рівноважні молярні концентрації катіонів і аніонів, а [CH3COOН] – рівноважна молярна концентрація недисоційованих молекул електроліту.
За рівнянням дисоціації : [H+] = [CH3COO-].
Отже:
[H+] = 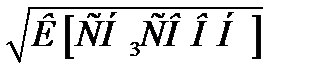
Розрахунок рН у розчинах слабких кислот проводять за рівнянням:
рН = 1/2рКа – 1/2lg cк,
де рКа = -lgКа – силовий показник слабкого електроліта.
Розрахунок рН у розчинах слабких основ проводять за рівнянням:
рН = 14 - 1/2 рК +1/2 lg cосн
| <== попередня сторінка | | | наступна сторінка ==> |
| ЗАДАЧІ ДЛЯ САМОСТІЙНОЇ РОБОТИ | | | Приклади розв’язання задач |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |