
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція № 3. Ненасичені вуглеводні
План
1. Будова алкенів і алкінів.
2. Ізомерія, номенклатура і способи одержання ненасичених вуглеводнів.
3. Фізичні, хімічні властивості та застосування алкенів і алкінів.
1. До ненасичених вуглеводнів належать сполуки, що мають у складі подвійні і потрійні зв'язки. Алкенами (олефінами) називають ненасичені вуглеводні, що містять у молекулі один подвійний карбон-карбоновий зв'язок. Найпростішим їх представником є етилен С2Н4. Гомологи етилену див. табл. 1.
Гомологічний ряд ненасиченихтабл. 1
| Формула | Назва алкену | Формула | Назва алкіну | ||
| молекулярна | структурна | молекулярна | структурна | ||
| С2Н4 | СН2=СН2 | етен | С2Н4 | СН≡СН | етин |
| С3Н6 | СН3-СН=СН2 | пропен | С3Н6 | СН3-С≡СН | пропін |
| С4Н8 | СН3СН2СН=СН2 | бутен | С4Н8 | СН3СН2С≡СН | бутин |
| С5Н10 | СН3(СН2)2СН=СН2 | пентен | С5Н10 | СН3(СН2)2С≡СН | пентин |
| С6Н12 | СН3(СН2)3СН=СН2 | гексен | С6Н12 | СН3(СН2)3С≡СН | гексин |
| С7Н14 | СН3(СН2)4СН=СН2 | гептен | С7Н14 | СН3(СН2)4С≡СН | гептин |
| С8Н16 | СН3(СН2)5СН=СН2 | октен | С8Н16 | СН3(СН2)5С≡СН | октин |
| С9Н18 | СН3(СН2)6СН=СН2 | нонен | С9Н18 | СН3(СН2)6С≡СН | нонин |
| С10Н20 | СН3(СН2)7СН=СН2 | декен | С10Н20 | СН3(СН2)7С≡СН | декін |
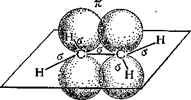
Алкени мають загальну формулу СnН2n, тобто ізомерні циклоалканам. Подвійний зв'язок (чьотирьохелектронний) утворюється за допомогою двох пар узагальнених електронів. Карбонові атоми, що зв'язані подвійним зв'язком, знаходяться у стані sр2-гібридизації, кожний з них утворює три s-зв'язки, що лежать в одній площині під кутом 120°. Негібридизовані орбіталі р-электронів розташовані перпендикулярно до площини s-зв'язків і паралельно один одному і внаслідок «бічного» перекривання утворюють другий зв'язок – p-зв'язок. Електронна хмара p-зв'язку частково розташована над площиною, а частково під площиною, у якій лежать атоми. Подвійний зв'язок це сполучення s- і p-зв'язків. Бічне перекривання негібридизованних р-орбіталей, що утворюють p-зв'язок, зближує атоми Карбону і відстань між ними стає коротшою – довжина подвійного С=С-зв'язку 0,133 нм (довжина простого С-С-зв'язку 0,154 нм). Схема розташування атомів і зв'язків у молекулі етилена наведена на рис. 1.
 а)
а) 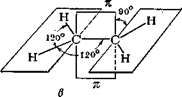
Рис. 1. Будова етилена: а) s-зв'язки і р-електронні хмари; в) – геометрія
2. Структурна ізомерія. Структурні ізомери алкенів можуть відрізнятися будовою карбонового ланцюга і положенням подвійного зв'язку. Так, для бутену С4Н8 відомі три ізомери:
СН2 = СН – СН2 – СН3 бутен-1 СН3 – СН = СН – СН3 бутен-2
 СН2= С – СН3 метилпропен
СН2= С – СН3 метилпропен
СН3
Цей приклад показує, що число ізомерів у алкенів вище, ніж у алканів.
Для етиленових сполук можлива просторова ізомерія, що зв'язана з розташуванням замісників стосовно площини подвійного зв'язку. Ця ізомерія спостерігається в тих випадках, коли кожний з атомів Карбону, зв'язаних подвійним зв'язком, витрачає інші дві одиниці валентності на зв'язок із двома різними замісниками. Розташування пари однакових замісників по одну сторону площини подвійного зв'язку дає цис-ізомер, по різні сторони – транс-ізомер, наприклад:
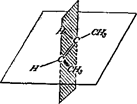
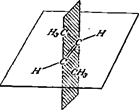
цис-бутен-2 (tпл = –139,3°С, tкип = +3,7 °С)
транс-бутен-2 (tпл = –105,8°С, tкип = +0,96 °С)
Перетворення цих ізомерів друг у друга вимагає обертання навколо подвійного зв'язку, тобто необхідно порушити перекривання р-орбіталей і розірвати p-зв'язок. На це потрібно затратити понад 250 кДж/моль енергії. Такий енергетичний бар'єр утруднює обертання й обумовлює існування цис-транс-ізомерів як стійких індивідуальних речовин. Природа цієї ізомерії така ж, як у заміщених циклах. Як правило, транс-ізомери більш стійкі, мають більш високу температуру плавлення. При нагріванні цис-транс-ізомери можуть переходити друг у друга: між ними встановлюється рівновага.
Тривіальні назви алкенів характеризуються закінченням илен (ілен): етилен, пропілен, бутилен і т.д. Раціональна номенклатура розглядає алкени як похідні етилена, що містять замість атомів Гідрогену вуглеводневі радикали; у разі потреби уточнюють положення радикалів у різних атомів етиленового угруповання, позначаючи їх грецькими буквами a і b, наприклад:
СН2= СН – СН2 – СН3 СН3 – СН = СН – СН3
етилетилен (бутен-1); a,b -диметилетилен (бутен-2).
За правилами систематичної номенклатури назви алкенів будують подібно назвам алканів, але закінчення ан заміняють на закінчення ен, звідки і відбувається загальна назва алкени. Як головний вибирають ланцюг, що включає подвійний зв'язок, навіть якщо цей ланцюг і не є самим довгим. Нумерацію проводять так, щоб атом Карбону, від якого починається подвійний зв'язок, одержав найменший номер; цим номером і вказують положення подвійного зв'язку. Наприклад:
 СН3 СН2
СН3 СН2
СН3 – СН – СН2 – С – СН2-СН3 2-етил-4-метилпентен-1
Загальна назва радикалів, утворених з алкенів – алкеніли. Приведемо для приклада назви деяких радикалів, що часто зустрічаються: СН2 = СН – етеніл; СН3– СН = СН – пропеніл; СН2 = СН – СН2 – алліл.
| <== попередня сторінка | | | наступна сторінка ==> |
| Окиснення алканів | | | Лекція № 5-6. Спирти і феноли. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |