
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Воднеподібні системи
H,He+,Li++
Стан електрона у воднеподібному атомі описується хвильовою функцією Ψ, яка є розв’язком стаціонарного рівняння Шредінгера :
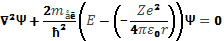
Не вдаючись до математичного розв’язання цієї задачі, обмежимось розглядом лише її важливих результатів.
1. Енергія
Рівняння Шредінгера має розв’язки , що зодовольняють вимогам однозначності, скінченності і неперервності хвильової функції ϕ лише при дискретних (власних) значеннях енергії
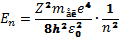 , (n=1,2,3,…)
, (n=1,2,3,…)
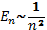 . (див. Рис.)
. (див. Рис.)
2. Квантові числа
Рівняння Шредінгера задовольняють власні хвильові функції Ψ=Ψn,I,mI , які
визначаються трьома квантовими числами:
головним n;орбітальнимI ;магнітним орбітальним mI. ( вони зв’язані).
Головне квантове число, n
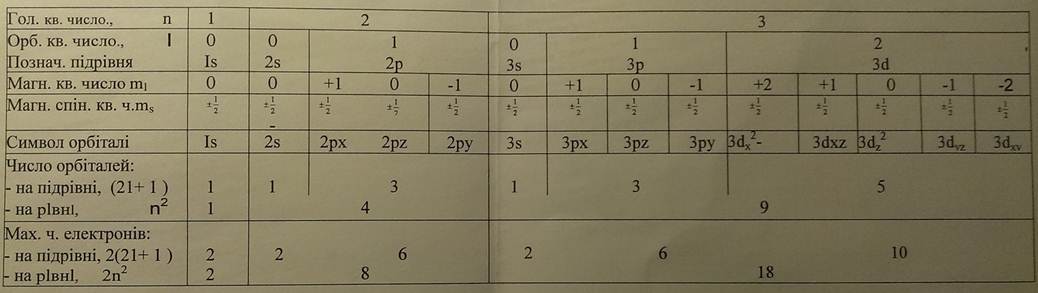
n -визначає середню відстань від ядра до ділянки підвищеної електронної густини, т.б. розміри електронної хмари та загальну енергію електрона на даному рівні; може набувати додатні цілочислові значення п = 1,2,3,4,...,∞.
Стан електрона , який характеризується певним n, називають енергетичним рівнем електрона в атомі. Для енергетичних рівнів електрона в атомі прийняті латинські позначення
| Головне квантове число | |||||||
| Енергетичні рівні | К | L | M | N | O | Р | Q |
Max кількість енергетичних рівнів, яку може мати атом в основному стані, відповідає номеру періоду, в якому розміщений даний хім. елемент.
Орбітальне квантове число, І
Тонка структура лінійчастих спектрів (мультиплетність) (складаються з кількох близько розміщених ліній, які відповідають переходу електрона з одного енергетичного рівня на інший) вказує на різні квантовані стани електрона на певному енергетичному рівні, що зумовлено різною формою електронних орбіталей. От же, основні енергетичні рівні складаються з певного числа енергетичних підрівнів.
Для характеристики енергії електрона на підрівні та форми електронних орбіталей, введено орбітальне квантове числоI.
З розв’язків рівняння Шредінгера випливає, що орбітальний момент імпульсу електрона LI квантується. Його модуль не може бути довільним, а набуває дискретних значень
 ,
,
при заданому n Iнабуває стільки ж значеньI = 0, 1, 2,..., (n-1).
Кожному I відповідає певний енергетичний підрівень
| Орбітальне квантове число, I | ||||
| Енергетичний підрівень | s | р | d | f |
( Буквені позначення підрівнів відповідають першим буквам англійських назв відповідних спектральних ліній, що виникають внаслідок електронних переходів , відповідно до значень I
sharp -різка; principal -ocновнa;diffus -дифузна; fundamental -фундаментальна ).
Можлива кількість підрівнів для даного енергетичного рівня п рівна номеру цього
рівня.
Магнітне орбітальне квантове число, mI,
У магнітному полі спектральні лінії атомів стають ширшими або розщепляються (з’являються нові близько розташовані лінії), збільшується мультиплетність. Це пояснюється тим, що електрон в атомі на всіх підрівнях(крім s -підрівня) характеризується крім орбітальним ще й магнітним орбітальним моментом. ( див. Рис.) Енергетичні зміни, які при цьому відбуваються , можна пояснити різним розміщенням електронних орбіталей у просторі, яке характеризується mI.
Магнітне поле орієнтує площину електронної орбіталі у просторі під певними кутами ( відбувається просторове квантування), при яких проекція орбітального моменту імпульсу LIz на напрямок зовнішнього поля набуває квантованих значень кратних ħ
LIZ=mI·ħ
де mI = 0, ±1,±2, … ,±I.
Т.б. всього  може прийняти (2I+1) можливих орієнтації
може прийняти (2I+1) можливих орієнтації
При даних n і I може бути декілька станів електрона з однаковою енергією. Такі стани називають виродженими.
Тому:
s - стан вироджено 1 раз, бо I= 0 mIмає 1 значення
р - стан вироджено 3 рази, бо I=1 mIмає 3 значення
d - стан вироджено 5 разів, бо I=2 mIмає 5 значень
f - стан вироджено 7 разів, бо I=3 mIмає 7 значень
За характером орієнтації у просторі
р- орбіталі позначають Px, Py, Pz;
d-орбіталі 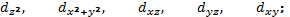
f - орбіталі мають ще складнішу форму. (див. Рис.)
Число різних станів, що відповідає даному n
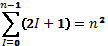
Квантові стани електронів; ємність рівнів, підрівнів електронних оболонок
| <== попередня сторінка | | | наступна сторінка ==> |
| Квантовані стани атома | | | Досліди Штерна і Герлаха. Спін електрона. Спінове квантове число. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |