
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
VI група катіонів
1. Реакції катіонів Ni2+
1.1. Їдкі луги при дії на солі нікелю утворюють осад гідроксиду,
розчинного у кислотах, гідроксиді і солях амонію. Запишіть спостереження і складіть рівняння проведених реакцій.
1.2. Гідроксид амонію при дії на іони Ni2+ спочатку осаджує основну сіль, яка потім розчиняється у надлишку реагенту:
NiCl2 + NH4OH = NiOHCl¯ + NH4Cl,
NiOHCl + 7NH4OH = [Ni(NH3)6](OH)2 + NH4Cl + 6H2O .
Назвіть сполуки, які утворюються, і зафіксуйте їх колір.
1.3. Гідрофосфат натрію утворює з іонами Ni2+ осад ортофосфату нікелю, розчинний у кислотах і надлишку аміаку:
3NiCl2 + 4Na2HPO4 = Ni3(PO4)2¯+ 2NaH2PO4 + 6NaCl .
Який колір осаду? Який висновок можна зробити при порівнянні кольорів нерозчинних сполук і розчинів солей нікелю?
1.4. Реакція Чугаєва.
Диметилгліоксим (СН3СNОН)2 (реактив Чугаєва) взаємодіє з аміачним розчином солей Ni2+, утворюючи яскраво-червоний осад внутрішньокомплексної солі:

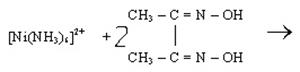
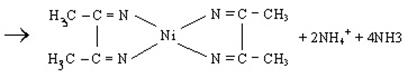 .
.
Це характерна якісна реакція на іони Ni2+. Визначенню заважає катіон Fe2+, який утворює з реактивом Чугаєва сполуку червоного забарвлення.
Для виконання реакції до 2–3 краплин розчину, який аналізується, додайте 3–5 краплин аміаку і 2–3 краплини спиртового розчину диметилгліоксиму.
2. Реакції катіонів Co2+
2.1. Їдкі луги і аміак виділяють з розчинів солей кобальту (ІІ) осад основної солі CoОНСl (напишіть рівняння реакцій), який розчиняється у кислотах і надлишку аміаку:
CoОНСl + 7NH4OH = [Co(NH3)6](OH)2 + NH4Cl + 6H2O .
Який колір має розчин? При стоянні осад змінює свій колір. Поясніть чому.
2.2. Гідрофосфат натрію реагує з катіонами Co2+ подібно іонам Ni2+. Зафіксуйте колір осаду та складіть рівняння реакції.
2.3. Характерною на катіони Co2+ є реакція “синього кільця”. До розчину солі кобальту (ІІ) додайте невелику кількість кристалів роданіду калію (натрію, амонію) і перемішайте. Утворюється роданідний комплекс:
CoCl2 + 4NH4SCN = (NH4)2[Co(SCN)4] + 2NH4Cl .
Додайте до розчину ізоаміловий спирт, який утворить на поверхні водного розчину органічний шар (кільце), забарвлений у синій колір. Виконанню реакції заважають катіони Fe3+, Cu2+, Hg22+ та інші. Катіони Fe3+ маскують додаванням сухого фториду натрію, а інші іони - розчином тіосульфату натрію. При цьому утворюються безбарвні комплекси.
3. Реакції катіонів Cu2+
3.1. Їдкі луги утворюють з іонами Cu2+ аморфний осад, який розчиняється в кислотах. Складіть рівняння реакцій і запишіть спостереження.
3.2. Гідроксид амонію осаджує катіони Cu2+ у вигляді основної солі:
2CuSO4 + 2NH4OH = (CuOH)2SO4¯+ (NH4)2SO4 .
Який колір має осад?
При додаванні надлишку аміаку осад розчиняється за реакцією:
(CuOH)2SO4¯ + (NH4)2SO4 + 6NH4OН = 2[Cu(NH3)4]SO4 + +8H2O
з утворенням яскраво-синього аміакату міді. Чому при підкисленні розчину змінюється його забарвлення? Складіть рівняння реакції. Реакцію з надлишком аміаку можна розглядати як характерну на катіони Cu2+ . Проте слід зважати на те, що за умови присутності катіонів Ni2+ вони також утворюють подібний, хоча менш інтенсивно забарвлений комплекс.
3.3. Метали, які у ряду напруг стоять до водню (наприклад, Al, Fe, Zn), відновлюють іони Cu2+ до вільного стану. При цьому метали вкриваються шаром міді. Запишіть рівняння реакції.
3.4. Гексаціаноферат (ІІ) калію утворює з катіонами Cu2+ червоно-бурий осад. Складіть рівняння реакції, яку застосовують як характерну для визначення Cu2+ у розчинах. Гідроксид амонію розчиняє гексаціаноферат (ІІ) міді. Складіть рівняння реакції.
4. Реакції катіонів Сd2+
4.1. Їдкі луги і гідроксид амонію утворюють з катіонами Cd2+ осад гідроксиду (якого кольору?). Напишіть рівняння реакцій утворення гідроксиду кадмію і його розчинення у кислотах. Надлишок гідроксиду амонію розчиняє гідроксид кадмію. Який колір має розчин? Складіть рівняння реакції.
4.2. Сірководень утворює з катіонами Сd2+ жовтий осад сульфіду кадмію. Ця реакція є характерною для катіонів кадмію. Складіть рівняння реакції у молекулярному та іонному вигляді.
5. Реакції катіонів Hg2+
5.1. Їдкі луги осаджують з розчинів солей ртуті (ІІ) оксид ртуті (гідроксид ртуті (ІІ) нестійкий). Який колір має осад? У чому він розчиняється? Напишіть рівняння реакцій.
5.2. Гідроксид амонію осаджує з розчинів солей ртуті (ІІ) осад амідної сполуки (який колір він має?):
Hg(NO3)2 + 2NH4OH = [HgNH2]NO3¯+ NH4NO3 + 2H2O .
Осад розчиняється в кислотах та концентрованому розчині аміаку:
[NH2Hg]NO3¯ + 2NH4OH + NH4NO3 → [Hg(NH3)4](NO3)2 + +2H2O .
Рівновага зміщується вправо при додаванні надлишку амонійних солей.
5.3. Йодид калію утворює з катіонами Hg2+ яскраво-червоний осад йодиду ртуті, розчинний у надлишку реактиву. Складіть рівняння реакції, яка є характерною на катіони Hg2+. Вона дозволяє відкрити катіони Hg2+ у присутності всіх інших катіонів, крім Ag+ i Pb2+.
5.4. Відновники (SnCl2, метали, включно з міддю) відновлюють іони Hg2+ до Hg22+, а потім до металічної ртуті. Складіть відповідні рівняння реакцій.
5.5. Сірководень і тіосульфат натрію у кислому середовищі при нагріванні з солями ртуті (ІІ) утворюють чорний осад сульфіду ртуті (ІІ), нерозчинний в азотній кислоті, але розчинний у царській горілці. Складіть рівняння реакцій.
6. Хід аналізу суміші катіонів VI аналітичної групи
Аналіз суміші катіонів VI групи можна виконати дробним методом, тобто за допомогою характерних реакцій з окремих проб.
6.1. Відкриття катіонів Cu2+
До 2–3 краплин розчину додайте 5–6 краплин концентрованого розчину аміаку. За наявності міді розчин забарвлюється в інтенсивно-синій колір. Щоб помилково не прийняти аміакат нікелю (теж синього кольору) за аміакат міді, зробіть з окремої проби перевірочну реакцію на Cu2+ з гексаціанофератом (ІІ) калію.
6.2. Відкриття катіонів Hg2+
До 2–3 краплин розчину додавайте краплями розчин йодиду калію. Поява червоного осаду йодиду ртуті свідчить про присутність у розчині іонів Hg2+.
6.3. Відкриття катіонів Co2+
До 2–3 краплин розчину додайте декілька кристаликів роданіду амонію (або калію), 0,1 см3 ізоамілового спирту, суміш збовтайте. У присутності іонів Co2+ органічне кільце забарвлюється у синій колір. Якщо кільце має брудно-жовтий колір, слід додати декілька кристаликів тіосульфату натрію і розчин збовтати.
6.4. Відкриття катіонів Ni2+
До 2–3 краплин розчину додайте 3–5 краплин розчину аміаку і 2–3 краплини спиртового розчину реактиву Чугаєва. Поява малинового забарвлення свідчить про наявність іонів Ni2+.
6.5. Відкриття катіонів Cd2+
Його можна здійснити лише після відокремлення іонів Cu2+, Hg2+, Ni2+ і Co2+ у вигляді сульфідів, які осаджуються з 1 н розчину соляної кислоти. Осад сульфіду кадмію за такої кислотності не утворюється, його появу фіксуємо лише після розведення розчину до необхідної кислотності. До 3 см3 розчину, що аналізується, додайте такий самий об’єм 2 н соляної кислоти, а потім сірководневої води. Осад, який випав, відфільтруйте, до фільтрату додайте нову порцію сірководневої води. Якщо розчин чорніє, осад знову відфільтруйте. Після цього розчин розведіть водою вдвічі і спостерігайте за появою жовтого осаду.
Контрольні питання, запитання та завдання
1. Закінчіть рівняння наступних реакцій:
Fe3O4 + NO3- =
FeAsS + NO3- =
FeCl3 + Na2S2O3 =
2. Які з катіонів V групи відкриваються за допомогою реакцій гідролізу? Наведіть рівняння цих реакцій.
3. Запропонуйте можливі способи перетворення у водному розчині іонів Fe3+ в іони Fe3+.
4. Гідроксид магнію розчиняється у кислотах та у розчинах солей амонію. Складіть відповідні рівняння, вкажіть ознаки, характерні для обох реакцій. Чи буде гідроксид кальцію поводити себе аналогічно?
5. Які особливості катіонів V групи враховуються при систематичному аналізі їх суміші?
6. Чи можуть існувати у розчині катіони Sn4+, As5+, Sb6+? Відповідь обґрунтуйте.
7. Яка характерна реакція використовується при аналізі катіонів як IV, так і V аналітичної групи?
8. До складу гексаціанофератів входять ціанід-іони. Чому ці солі не отруйні?
9. Використовуючи таблицю стандартних електродних потенціалів (додаток 3), визначте напрями перебігу наступних реакцій:
Mn2+ + Cl2 + H2O ® MnO4- + Cl- + H+,
MnO4- + Bi3+ + H2O ® Mn2+ + BiO3- + H+,
Fe3+ + I- + H2O ® Fe2+ + IO3- + H+.
10. Запишіть рівняння відкриття іонів V i VI груп, в яких відбуваються окисно-відновні перетворення.
11. На прикладі реакції “синього кільця” поясніть суть процесу екстракції.
12. Як здійснюється маскування катіонів, які заважають визначенню катіону Cо2+?
13. Складіть перелік забарвлених осадів, які використовуються при визначенні катіонів VI групи.
14. Які способи видалення іонів, що заважають відкриттю інших іонів, використовують в аналізі? Наведіть конкретні приклади і складіть рівняння відповідних реакцій.
| <== попередня сторінка | | | наступна сторінка ==> |
| V група катіонів | | | Лабораторна робота 1.4 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |