
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Порядок і рекомендації щодо виконання роботи
1. Приготування робочого розчину соляної кислоти
За допомогою ареометра визначить густину концентрованої соляної кислоти ρHCl. За таблицею (додаток 1) знайдіть масову частку HCl у цьому розчині ωHCl. Обчисліть масу HCl mHCl, необхідну для приготування 500 см3 0,1 н розчину соляної кислоти. Вирахуйте на масу концентрованої соляної кислоти mконцНCl. Проте зважувати таку летку кислоту, якою є концентрована HCl, незручно, тому необхідно перевести її масу в об’єм VконцНCl.
Відміряйте знайдений об’єм концентрованої соляної кислоти за допомогою бюретки або невеликої мензурки і додайте дистильовану воду до 500 см3. Не забудьте ретельно перемішати одержаний розчин.
Виміри і розрахунки
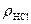 =
= 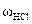 =
=
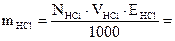
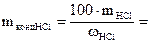
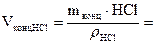
2. Приготування 0,1 н стандартного розчину тетраборату натрію
Вихідною речовиною, найзручнішою для встановлення точної концентрації соляної кислоти, є тетраборат натрію Na2B4O7×10H2O (бура). Водний розчин його має, завдяки гідролізу, лужну реакцію:
Na2B4O7 + 5H2O + 2HCl = 2NaCl + 4H3BO3 .
Розрахуйте і візьміть наважку бури, яка відповідає 250 см3 0,1 н її розчину.
Бура погано розчиняється у холодній воді, тому до наважки у стакан приливайте гарячу дистильовану воду порціями, кожного разу перемішуючи скляною паличкою і переносячи розчин у мірну колбу місткістю 250 см3. Після повного розчинення дайте розчину охолонути, потім об’єм його доведіть до риски мірної колби і ретельно перемішайте.
Виміри і розрахунки
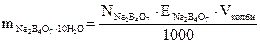 ,
,
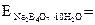
3. Встановлення нормальності розчину соляної кислоти за тетраборатом натрію
Ретельно вимиту бюретку сполосніть невеликими порціями робочого розчину соляної кислоти з метою видалення залишків води. Користуючись лійкою, заповніть бюретку соляною кислотою, включно з її нижньою частиною, витиснувши з неї бульбашки повітря. Потім зніміть лійку і встановіть нижній край меніску на нульовій позначці.
За допомогою чистої піпетки відберіть аліквотну частину розчину тетраборату натрію і перенесіть її у конічну колбу для титрування. Додайте у колбу 2-3 краплини метилоранжу.
Під колбу з розчином підкладіть листок білого паперу і приступайте до титрування. У точці еквівалентності спостерігається перехід забарвлення з жовтого у рожевий. Кількість титрувань повинна бути такою, щоб різниця між трьома результатами не перевищувала 0,1 см3.
З цих вимірів візьміть середнє арифметичне і підрахуйте нормальність розчину соляної кислоти.
Виміри і розрахунки
На титрування об’єму 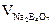 пішло соляної кислоти:
пішло соляної кислоти:
V1 = V2 = V3 =
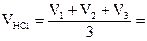
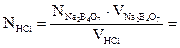
Методики взяття наважок, приготування розчинів, титрування, проведення вимірів і розрахунків, які описані у даній роботі, є типовими і застосовуються в інших титрометричних визначеннях.
Контрольні питання, запитання та завдання
1. Назвіть основні методи титриметрії.
2. Яке обладнання необхідне для здійснення титриметричних аналізів?
3. У чому полягають переваги об’ємного методу аналізу перед ваговим?
4. Які способи застосовуються для приготування робочих розчинів титриметрії?
5. Чому дорівнює нормальна концентрація розчину гідроксиду барію, який містить 1,0625 г речовини в 250 см3 розчину?
6. Яку масу оксиду кальцію можна нейтралізувати 10 см3 0,2 н розчину соляної кислоти?
7. Наважку каустичної соди масою 1,1013 г розчинили у 250 см3 води. На титрування 25,0 см3 цього розчину витрачено 25,9 см3 0,1 н сірчаної кислоти. Чому дорівнює масова частка гідроксиду натрію у пробі?
8. Який об’єм концентрованої соляної кислоти (ρ = 1,19 г/см3), що містить 38% HCl, треба взяти для приготування 1 дм3 2 н розчину?
9. Який об’єм 10%-вої сірчаної кислоти витратиться на нейтралізацію розчину, що містить 16,0 г гідроксиду натрію?
10. Який об’єм 0,2 н розчину лугу знадобиться для осадження у вигляді Fe(OH)3 всього заліза, що міститься в 10 см3 0,5 н розчину хлориду заліза (III)?
| <== попередня сторінка | | | наступна сторінка ==> |
| Основні теоретичні відомості | | | Лабораторна робота 3.2 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |