
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Правила техніки безпеки
ЗМІСТ
Арк.
| Вступ…………………………………………………………………………. | |
| Загальні правила виконання лабораторних робіт……………………… | |
| Лабораторна робота 1 Класи неорганічних сполук……………………… | |
| Лабораторна робота 2 Визначення молярної маси еквіваленту магнію.. | |
| Лабораторна робота 3 Визначення молярної маси діоксиду вуглецю…… | |
| Лабораторна робота 4 Реакції окиснення – відновлення………………….. | |
| Лабораторна робота 5 Кінетика хімічних реакцій………………………… | |
| Лабораторна робота 6 Хімічні властивості металів……………………….. | |
| Лабораторна робота 7 Гальванічні елементи. Корозія металів…………... | |
| Лабораторна робота 8 Електроліз розчинів солей………………………… | |
Вступ
Хімія – одна з фундаментальних наук, без вивчення якої неможлива подальша освіта за рівнем фахівця з спеціальностей «Електротехніка та електротехнологія» та «Електромеханіка». Подальше вивчення спеціальних дисциплін є неможливим без знань основних хімічних процесів.
Мета лабораторних робіт з дисципліни «Хімія» - закріплення теоретичних знань, які одержані під час вивчення теоретичного матеріалу, придбання практичних навичок проведення основних хімічних аналізів.
Під час виконання лабораторних робіт студенти складають та захищають звіт, у якому повинно бути наведено:
- дата виконання роботи;
- номер та назва роботи;
- мета роботи;
- опис методики виконання роботи, схеми лабораторних установок;
- необхідні розрахунки;
- результати дослідження та розрахунків, які наведено у вигляді таблиць, графіків та ін.;
- аналіз результатів роботи та висновки.
Усі звіти за окремими лабораторними роботами повинні бути наведені у одному зошиті і оформлені згідно вимогам до оформлення лабораторних робіт, курсових та дипломних проектів.
Загальні правила виконання лабораторних робіт
Лабораторні роботи є однією із важливіших складових частин курсу хімії. Для їх виконання студенту необхідно ознайомитись з лабораторним обладнанням, вимірювальними приладами, а також з технікою проведення основних лабораторних операцій.
Оскільки в хімічній лабораторії знаходяться електроприлади, ядовиті і вогненебезпечні речовини, студенти повинні точно дотримуватися правил внутрішнього розпорядку і техніки безпеки.
Перед кожним лабораторним заняттям студент повинен вивчити відповідний розділ підручника, конспекту лекцій і методику виконання досліду.
При оформленні звіту в лабораторному журналі записують: дату, номер, назву лабораторної роботи; конспект теоретичного матеріалу; стислий опис ходу виконання досліду і отримані результати.
При проведенні досліду необхідно дотримуватися наступних правил:
1. У лабораторіях студенти зобов'язані працювати в халатах і виконувати лише ті досліди, які передбачені темою лабораторної роботи під наглядом викладача або лаборанта.
2. Під час роботи з посудом, реактивами і приладами студент повинен бути максимально обережним, уважним і охайним.
3. На кожному робочому місці повинні бути посуд та реактиви, які необхідні для роботи; переносити їх з місця на місце не дозволяється.
4. Студент повинен чітко дотримуватися методики виконання досліду.
5. Посуд для дослідів завжди повинен бути чистим і сухим.
6. Забороняється виливати надлишок реактиву із пробірки назад до реакційної склянки.
7. Не слід плутати пробки від різних склянок. Щоб внутрішня поверхня пробки залишалась чистою, відкриваючи склянку з реактивом, пробку потрібно тримати у руці або покласти на стіл зовнішньою поверхнею.
8. Після виконання досліду залишки металів не викидають до раковини, а збирають до склянки.
9. Реактиви, що дорого коштують (наприклад, залишки солей срібла) збирають до спеціального посуду.
10. Битий посуд, залишки паперу, сірники викидають до урни.
11. Забороняється захаращувати своє робоче місце зайвими предметами.
Правила техніки безпеки
1. Забороняється торкати, вмикати і вимикати без дозволу викладача електричні прилади і рубильники.
2. Забороняється брати хімічні речовини руками і куштувати їх на смак.
3. Лабораторні роботи з отруйними та леткими речовинами (хлоридна кислота, амоніак та інші) потрібно виконувати тільки у витяжній шафі.
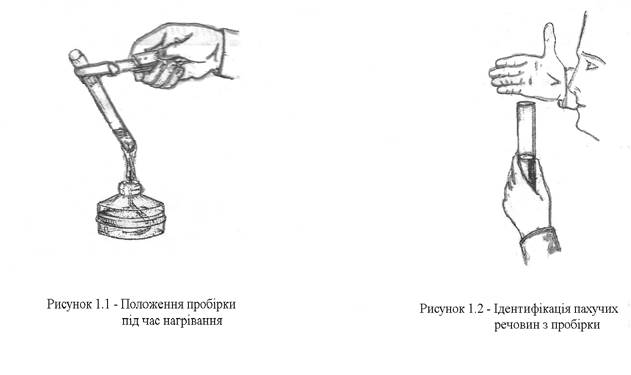
4. Під час нагрівання пробірок і колб з реактивами потрібно користуватися тримачем.
5. При нагріванні пробірки над полум'ям спочатку потрібно нагріти усю пробірку рівномірно, але не вище від рівня рідини у пробірці і слідкувати за тим, щоб її отвір був спрямований в протилежний бік від себе і колег (рисунок 1.1).
6. Забороняється зазирати в посудину, яку нагрівають або в яку наливають реактив.
7. Нюхати вміст посуду потрібно обережно, направляючи помахом руки леткі речовини до носа (рисунок 1.2).
8. Луги, кислоти і вогненебезпечні речовини зливати у раковину забороняється.
9. Розлиту кислоту нейтралізують лугом, а потім змивають великою кількістю води. Леткі й легкозаймисті речовини нагрівають лише на водяній або електричній плитці із закритою спіраллю. Нагрівати вогненебезпечні речовини на відкритому полум'ї забороняється.
10. При розведенні концентрованих кислот, особливо сірчаної, обережно уливають кислоту до води.
11. Забороняється залишати без нагляду включені електроприлади в лабораторії.
12. Після закінчення роботи необхідно хімічний посуд помити, робоче місце прибрати.
Лабораторна робота № 1
Класи неорганічних сполук
1.1 Теоретична частина
До неорганічних сполук відносяться оксиди, основи, солі й кислоти.
Оксиди.
Оксидами називаються складні речовини, які складаються із двох елементів, один з яких кисень зі ступенем окиснення 2-.
Оксиди підрозділяються на оксиди, які утворюють сіль та оксиди, які сіль не утворюють.
Сіль утворюючі оксиди це оксиди, які в результаті хімічних реакцій здатні утворювати солі. Сіль не утворюючі оксиди таку здатність не мають.
Сіль утворюючі оксиди підрозділяються на основні, кислотні й амфотерні.
Основними оксидами називаються такі оксиди, яким у якості гідратів (продуктів приєднання води) відповідають основи. Основні оксиди вступають у реакції з кислотними оксидами й кислотами.
Кислотними оксидами називаються такі оксиди, яким у якості гідратів відповідають кислоти. Кислотні оксиди називають також ангідридами кислот. Кислотні оксиди утворюють неметали й метали при прояві ними високої валентності. Кислотні оксиди взаємодіють із основними оксидами й основами.
Амфотерні оксиди це оксиди, які залежно від умов проявляють властивості як основних (у кислому середовищі), так і кислотних (у лужному середовищі) оксидів. Амфотерні оксиди (ВеО, Аl2О3, РЬО, ZnO, PbO2, SnO, Cr2O3) вступають у реакції з кислотними й основними оксидами, з кислотами й основами, наприклад:
ZnО + SO2→ ZnSO4;
ZnО + Na2O→ Na2ZnO2;
ZnО + H2SO4 → ZnSO4 + Н2О;
ZnО + 2NaOH → Na2ZnO2 + Н2О.
Кислоти.
До складу молекули кислоти входять іони водню й кислотного залишку.
Кислоти вступають у реакції з багатьма речовинами: металами, основними й амфотерними оксидами, основами, солями.
Основи.
До складу молекули основи входять іони металів і гідроксилу.
Розчинні у воді основи називаються лугами. Іноді їх одержують при взаємодії основних оксидів (активних металів) з водою.
Загальним методом одержання нерозчинних у воді основ є реакція обміну між розчинами солі й луги, наприклад:
CdCl2 + 2NaOH → Cd(OH)2 + NaCl2.
Основи вступають у реакції з кислотними й амфотерними оксидами, кислотами й солями.
Амфотерні гідроксиди.
Амфотерні гідроксиди мають двоїні властивості: властивості кислот і основ. Тому вони існують у двох формах, між якими є взаємний перехід, і залежно від умов може переважати будь - яка із них.
При цьому в розчині існує рівновага, наприклад:
Zn2+ + 2OH- ↔ Zn(OH)2 ↔ H2ZnO2 ↔ 2H+ + ZnO22-,
де Zn(OH)2 – основа (основна форма);
H2ZnО2 – кислота (кислотна форма).
У водяних розчинах кислотна форма існує, як правило, у гідратованому виді.
Амфотерні гідроксиди взаємодіють із кислотами й лугами, наприклад:
Zn(OН) + 2HСl → ZnCl2 + 2H2O
Zn(OН) + 2NaOH → Na2[Zn(OH)4]
Солі.
До складу молекули солі входять основні й кислотні залишки. Солі бувають: кислі, основні, середні.
Молекули кислих солей містять іони металів і іони кислотних залишків, що містять водень, наприклад, NaHCO3, Cu(HSO4)2.
Молекули основних солей містять іон основного залишку, містить гідроксил, і іони кислотних залишків, наприклад (CuOH)2CO3.
Молекули середніх солей містять іони металів і іони кислотних залишків, наприклад Na2CO3, CuSO4, FeCl3.
Кислі солі одержують при взаємодії середньої солі з надлишком однойменної кислоти, наприклад:
Na2SO4 + H2SO4 → 2NaHSO4.
Основні солі можна одержувати при взаємодії середньої солі з недостатньою кількістю лугу, наприклад:
2CuSO4 +2NaOH → (CuOH)2SO4 + Na2SO4.
1.2 Практична частина
Дослід 1. Взаємодія оксиду магнію з водою.
Взяти (шпателем) щіпочку оксиду магнію або оксиду кальцію й насипати в пробірку. Долити декілька крапель води й 1-2 краплі фенолфталеїну. Спостерігати фарбування. Написати рівняння реакцій одержання гідроксиду кальцію й магнію.
Дослід 2. Властивості амфотерного оксиду цинку.
У дві пробірки насипати по щіпочці оксиду цинку. Потім в одну пробірку налити по краплях соляну кислоту (1:4), а в другу – концентрований розчин їдкого натру до розчинення осаду, уміст пробірки нагріти. Написати рівняння реакцій у молекулярному й іонному виді.
Дослід 3. Одержання оцтової кислоти.
Відібрати в пробірку щіпочку ацетату натрію CH3COONa, долити декілька крапель розведеної сірчаної кислоти. Виявити запах оцту. Написати рівняння реакції в молекулярному й іонному виді.
Дослід 4. Одержання гідроксиду нікелю (ІІ).
До декілька крапель солі нікелю(ІІ) долити трохи крапель розведеного розчину луги. Спостерігати виділення світло-зеленого осаду гідроксиду нікелю(ІІ). Написати рівняння реакції в молекулярному й іонному виді.
Дослід 5. Одержання й властивості гідроксиду алюмінію.
а) до 5-6 крапель солі алюмінію обережно долити 1-2 краплі (не більше!) розведеного розчину лугу. Спостерігати виділення осаду Al(OH)3, потім ще додати надлишок розчину луги до розчинення осаду. Сюди ж долити трохи крапель розведеного розчину сірчаної кислоти до розчинення осаду. Написати рівняння реакцій одержання гідроксиду алюмінію й розчинення його в кислоті в молекулярному й іонному виді.
б) до 5-6 крапель солі алюмінію долити по краплях розчин луги до утворення осаду Al(OH)3, потім ще додати надлишок розчину луги до розчинення осаду. Написати рівняння реакцій, мати на увазі, що утворюється розчин тетрагідроксоалюмінату натрію Na[Al(OH)4].
Дослід 6. Одержання гідросульфату міді.
У дві пробірки налити однакову кількість крапель (5-6) розчину сульфату міді. Потім долити в одну пробірку 1-2 краплі розчину луги, а в іншу – 5-6 крапель. Спостерігати появу в першій пробірці осаду салатного кольору гідроксосульфату міді (CuOH)2SO4, а в другій – блакитного осаду гідроксиду міді Cu(OH)2. Обидві пробірки нагріти. Спостерігати не змінний цвіт осаду у першій пробірці та почорніння в другій пробірці за рахунок розкладання. Написати рівняння реакцій утворення (CuOH)2SO4, Cu(OH)2 і розкладання Cu(OH)2 при нагріванні в молекулярному й іонному виді.
1.3 Контрольні питання й завдання
1. Охарактеризувати основні класи неорганічних сполуках.
2. Що таке амфотерність? Наведіть приклади.
3. Назвіть основні методи одержання оксидів. Наведіть конкретні приклади.
4. Напишіть формули оксидів, які можна одержати, розкладаючи нагріванням H2SiO3, CaCO3, Pb(NO3)2, NH4VO3.
5. З якими з перерахованих речовин буде реагувати соляна кислота: Zn(OH)2, CaO, AgNO3, H2SO4, P2O5? Напишіть рівняння реакцій.
6. Які із зазначених нижче речовин будуть реагувати з їдким натром: HNO3, CaO, CO2, CuSO4, P2O5? Напишіть рівняння реакцій.
Лабораторна робота № 2
Визначення молярної маси еквіваленту магнію
2.1Теоретична частина
Еквівалентом елемента називають таку його кількість, яка може приєднати або замістити 1,008 одиниць маси водню або 8 одиниць маси кисню.
Кількість речовини вимірюють у молях. Моль – кількість речовини, яка містить стільки структурних одиниць (молекул, атомів, іонів, електронів та ін.), скільки атомів міститься у 0,012 кг вуглецю–12. Число структурних одиниць, що міститься в одному молі речовини (константа Авогадро), для практичних розрахунків приймають рівним 6,02×1023 моль-1. Маса одного еквівалента елемента називається молярною масою еквівалента.
Усі елементи (або речовини) поєднуються між собою у кількостях, пропорційних їх еквівалентам (закон еквівалентів).
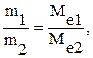
де m1, m2 – маси елементів (або речовин),
Mе1, Mе2 – молярні маси еквівалента першої та другої речовини.
На основі закону еквівалентів можна вивести наступні формули для розрахунку еквівалентних мас складних речовин:
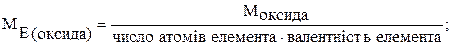
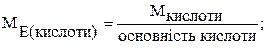
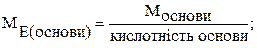
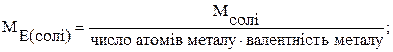
де М – молярна маса.
Еквівалентним об’ємом називають об’єм, який займає при даних умовах 1 моль еквівалентів речовини. Значення еквівалентного об’єму речовини, що знаходиться у газоподібному стані, можна знайти, знаючи, що в мольному об’ємі будь-якого газу, який складається із одноатомних молекул, міститься 1 моль атомів газу; якщо складається із двох атомних молекул – 2 моля атомів і т.д. Так, в 22,4 л Н2 міститься при нормальних умовах 2 моля атомів водню. Оскільки еквівалент водню дорівнює 1моль (1,008 г), то в 22,4 л Н2 міститься 2 еквівалента водню, тобто еквівалентний об’єм водню рівний 22,4:2=11,2 л/моль. Аналогічно, еквівалентний об’єм кисню О2 дорівнює 5,6 л/моль.
Визначити молярну масу еквівалента можна різними засобами:
1. Якщо елемент утворює сполуку з воднем або киснем, його еквівалент може бути визначений безпосередньо з цієї сполуки (метод прямого визначення).
2. Якщо елемент витісняє водень із його сполук, то еквівалент такого елементу може бути визначений за кількістю водню, що витісняється (метод витиску).
3. У багатьох випадках еквівалент визначають за складом сполуки даного елемента з будь-яким іншим (не киснем і не воднем), еквівалент якого відомий (метод посереднього визначення).
Між еквівалентом, атомною масою і валентністю існує взаємозв’язок:
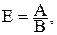
де Е – еквівалент елемента,
А – атомна маса,
В – валентність.
У цій роботі використовуємо метод витиску, заснований на визначенні кількості водню, що витісняється певною кількістю магнію із розбавленої сірчаної кислоти.
При визначенні еквівалента металу за цим методом вимірюють об’єм водню, що витісняється при реакції, і доводять його до нормальних умов. За найденим об’ємом обчислюють масу водню і розраховують масу металу, що припадає на одну одиницю маси водню, тобто молярну масу еквівалента магнію.
2.2 Практична частина
Для виконання роботи збирають прилад (рисунок 2.1), що складається з бюретки (1) ємністю 50 мл, яка поєднана зі зрівняльною ємністю (2) і реакційною посудиною (3) за допомогою гумових трубок (4).
Роботу виконують в наступній послідовності:
1) Перед початком досліду прилад потрібно випробувати на герметичність. Для цього необхідно підняти й опустити лійку, при цьому рівень води в бюретці не повинен підніматися й опускатися;
2) вийняти пробку з пробірки (реакційна посудина) й установити рівень води в бюретці на нульовій подільці або трохи нижче;
3) налити через лійку 1/4 частину пробірки сірчаною кислотою;
4) наважку магнію, що знаходиться в папірці, прикріпити до вологої стінки пробірки так, щоб магній не стикався з кислотою;
5) сумістити рівні в бюретці і лійці (щоб тиск усередині приладу дорівнював атмосферному). Записати рівень води в бюретці - Н1= (мл);
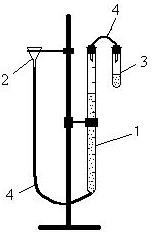
Рисунок 2.1. – Прилад для визначення еквівалента
1 – бюретка; 2 – зрівняльна ємність; 3 – реакційний посуд; 4 – гумові трубки.
6) струснути наважку магнію в кислоту, спостерігати виділення водню і витиснення води з бюретки;
7) по закінченні реакції дати пробірці охолонути, після чого знову сумістити рівні в бюретці і лійці. Записати рівень води в бюретці – Н2= (мл);
8) записати умови досліду:
Р – атмосферний тиск за барометром, мм рт. ст.;
t – температура повітря, °C;
h – тиск водяного пару при даній температурі (див. таблицю 2.1);
9) розрахувати молярну масу еквівалента магнію:
а) по різниці між рівнями води в бюретці до і після досліду знайти об’єм (V, мл) виділеного водню за даних умов:
V = (H2 – H1);
б) привести знайдений об’єм до нормальних умов за формулою:
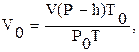
де Р0=760 мм рт. ст.;
Т=T0+t=273+t.
Так як водень збирається над водою, то над її поверхнею буде суміш Н2 і парів води, що насичують газ в залежності від температури. Тиск газу і водяного пару h у сумі буде дорівнювати атмосферному тиску.
Таблиця 2.1 – Тиск насиченого водяного пару
| Температура, 0С | Тиск | Температура, 0С | Тиск | ||
| кПа | мм рт.ст. | кПа | мм рт.ст. | ||
| 1,49 1,58 1,68 1,81 1,93 2,07 2,20 2,33 2,49 | 11,2 11,9 12,6 13,6 14,5 15,5 16,5 17,5 18,7 | 2,64 2,81 2,99 3,17 3,36 3,56 3,75 3,97 4,21 | 19,8 21,1 22,4 23,8 25,2 26,7 28,1 29,8 31,6 |
Щоб визначити власний (парціальний) тиск водню, слід із загального тиску відняти парціальний тиск водяних парів;
в) визначити масу водню, що витискується, виходячи із молярного об’єму:
22,4 л - 2,016 г
V0 л - m1
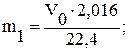
г) обчислити молярну масу еквівалента магнію:
m1 - m2
1,008 - МЕ(Mg)
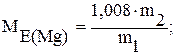
де m2 - наважка магнію у грамах;
д) при обчислюванні можна використовувати об’єм, який займає 1 еквівалент водню - 11,2 л:
V0 л - m2
11,2 - МЕ(Mg)
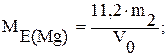
е) порівняти отриманий еквівалент магнію з теоретичним, обчислити процент похибки досліду за формулою:
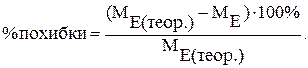
2.3 Контрольні питання й завдання
1. Що таке еквівалент елементу?
2. Які існують засоби визначення молярної маси еквіваленту?
3. Як визначити власний (парціальний) тиск водню?
4. Як обчислити еквівалент елементу і складної речовини?
5. Щоб окислити 1,815 г чотирьохвалентного металу потрібно 560 см3 кисню (при н.у.). Розрахуйте еквівалент металу і складіть формулу оксиду.
6. Щоб утворити 20,054 г сполуки лужного металу з воднем, що називається гідридом, потрібно 5600 см3 водню (н.у.). Визначте еквівалент лужного металу і встановить його формулу.
7. При взаємодії 5,750 г металу з 9,125 г кислоти виділилось 2800 см3 водню (н.у.). Розрахуйте еквівалент металу і кислоти.
8. При згорянні 1,19 г металу утворилось 1,51 г оксиду. Розрахуйте еквівалент металу і оксиду.
9. При нейтралізації 2,45 г кислоти лугом отримано 3 г солі і 0,45 г води. Розрахуйте еквівалент кислоти і солі, якщо відомо, що еквівалент води дорівнює 9.
10. Розрахуйте еквівалент металу і оксиду, якщо відомо, що при відновленні воднем 3,977 г оксиду утворилось 3,177 г металу.
Лабораторна робота № 3
Визначення молярної маси діоксиду вуглецю
3.1 Теоретична частина
Молярна маса – це маса одного молю речовини. Моль будь-якого газу за нормальних умов займає об’єм 22,4 л.
Визначити молярну масу газоподібної речовини можливо:
І. За рівнянням Менделєєва - Клапейрона:
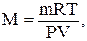
де m – маса газу;
V – об’єм газу;
Р – тиск;
R – газова постійна;
T – температура за абсолютною шкалою.
ІІ. За мольним об’ємом, якщо відома абсолютна щільність газу (ρ), тобто маса 1 л даного газу за нормальних умов:
М = 22,4 · ρ.
ІІІ. За відносною щільністю газу. Відносна щільність одного газу за другим газом (D) являє собою відношення мас цих обох газів, що узяті і рівних об’ємах за однаковими умовами:
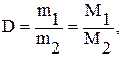
де m1, m2 –маси відповідно першого і другого газу;
М1, М2 – молярні маси газів.
Відносну щільність як правило визначають за воднем, тоді молярна маса дорівнює:
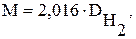
або за повітрям, тоді: М = 29 · Dп.
3.2 Практична частина
1. Зовсім суху колбу місткістю - 250-300 мл закрити пробкою до мітки і зважити на технохімічних вагах. Записати масу колби з повітрям – m1.
2. Зважену колбу наповнити просушеним діоксидом вуглецю. Пропускати діоксид вуглецю в колбу протягом 3-5 хвилин. Повноту наповнення колби визначити палаючою лучиною, підносячи її до отвору колби. Якщо лучина гасне, то діоксид вуглецю пропускають ще біля хвилини, потім повільно виймають газовідвідну трубку і лише тоді припиняють подачу газу.
3. Закрити колбу пробкою до мітки і знову зважити, записати масу колби з діоксидом вуглецю (СО2) – m2.
4. Визначити об’єм колби. Для цього колбу наповнити водою до мітки, перелити воду до мірного циліндра і визначити її об’єм (V) в мл.
5. Записати умови досліду: Р – атмосферний тиск за барометром, мм рт. ст.; t– температура повітря, 0С.
6. Розрахувати молярну масу діоксиду вуглецю різними засобами:
а) розрахунок за мольним об’ємом.
Привести об’єм газу в колбі V до нормальних умов за формулою:
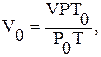
де Т0 = 273 К;
Р0 = 760 мм рт. ст.;
Т = Т0 + t = 273 + t.
Визначити масу повітря, що знаходиться у колбі (m3):
29 г - 22400 мл
m3 г - V0 мл
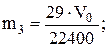
знайти масу порожньої колби: m4=m1-m3;
знайти масу вуглекислого газу, що знаходиться у колбі (m5): m5=m2-m4;
обчислити молярну масу СО2:
V0 мл - m5 г
22400 - М
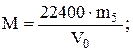
б) розрахунок молярної маси за щільністю відносно водню.
Знайти масу водню в об’ємі колби (m6):
2,016 г - 22400 мл
m6 г - V0 мл
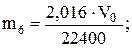
знайти щільність вуглекислого газу за воднем: 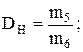
визначити молярну масу СО2: М = 2,016 × DH;
в) розрахунок молярної маси за рівнянням Менделєєва-Клапейрона:
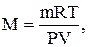
де m – маса газу в г;
V – об’єм СО2 в мл;
Р – тиск в мл рт.ст.;
R – газова постійна 62400 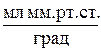 ;
;
T – температура за абсолютною шкалою.
7. Визначити відносну похибку досліду (в %) за формулою:
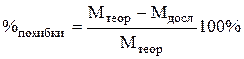 .
.
3.3 Контрольні питання й завдання
1. Що називають відносною щільністю газу?
2. Що таке універсальна газова постійна?
3. Як привести об’єм газу до нормальних умов?
4. У яких одиницях вимірюється газова постійна в системі SI?
5. Маса 596 см3 газу при 25°С і тиску 90972 Па дорівнює 0,442 г. Обчислите відносну щільність газу по повітрю та його молекулярну масу.
6. Маса 400 см3 газу при нормальних умовах дорівнює 1,036 г. Обчислите щільність цього газу по водні і його молекулярну масу.
7. Маса 340 см3 газу при 98420 Па і 21°С дорівнює 0,604 г. Обчислите
молекулярну масу газу.
8. Рівні об’єми хлору й оксиду азоту важать відповідно 3,16 та 1,34 г. Визначите молекулярну масу оксиду азоту з щільності по відношення до хлору, якщо молярна маса останнього дорівнює 70,9.
9. Один літр газоподібної речовини при нормальних умовах важить 0,76 г. Маса літра повітря і водню за тих самих умов відповідно дорівнює 1,293 і 0,09 г. Обчислите молярну масу газу трьома способами.
10. Газоподібна речовина при 102410 Па і 27 °С займає обсяг 380 см3 і має масу 0,5 г. Визначите молярну масу речовини.
Лабораторна робота № 4
Реакції окиснення - відновлення
4.1 Теоретична частина
Реакції, у результаті яких змінюються ступені окиснення елементів, називаються (ОВР).
Окиснюваність –це нерівномірність розподілу електронів між атомами в сполуках. При цьому елемент, електрони котрого зміщаються до атомів іншого елемента, проявляють додатну окиснюваність. Елемент, до атомів якого зміщаються електрони атома іншого елемента, проявляє від’ємну окиснюваність.
Число електронів, зміщених від одного атома до другого, називається ступенем окиснення.
Наприклад, реакція
+7 - 1 + 2 0 - 1
KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O
є окисно – відновною, тому що в ній у марганцю ступінь окиснення змінюється від +7 до +2, а у хлору - від -1 до 0.
Процес втрати електронів називається окисненням, а процес приєднання електронів – відновленням, наприклад:
2Cl- -2ē → Cl20 - окиснення;
Mn+7 +5ē → Mn+2 – відновлення.
Наведені рівняння називаються електронними.
Речовини, які в процесі реакції віддають електрони, називаються відновлювачами, а речовини, які приєднують електрони, - окиснювачами.
Написати рівняння окисно – відновної реакції – це значить:
- правильно написати продукти ОВР;
- розставити стехіометричні коефіцієнти в рівнянні реакції.
Правильно складене рівняння реакції є вираженням закону збереження маси речовин.
Наприклад, потрібно розставити коефіцієнти в рівнянні ОВР
KMnO4 + H2SO4 + Na2S → S + MnSO4 + K2SO4 + Na2SO4 + H2O
Для того щоб підібрати коефіцієнти в рівнянні:
- визначають, які елементи і як змінюють свій ступінь окиснення до реакції та після неї
+ 1 + 7 - 2 + 1 + 6 – 2 + 1 – 2 0 + 2 + 6 – 2 + 1 + 6 – 2 + 1 + 6 – 2 + 1 – 2
KMnO4 + H2SO4 + Na2S → S + MnSO4 + K2SO4 + Na2SO4 + H2O
Ступінь окиснення змінює Mn від +7 до +2 і S від -2 до 0;
- складають електронні рівняння
Mn+7 +5ē → Mn+2 (Mn+7 - окиснювач);
S-2 -2ē → S0 (S-2 - відновлювач);
- з того що число електронів, що втрачає відновлювач, повинно дорівнювати числу електронів, приєднаних окиснювачем, знаходять коефіцієнти для окиснення й відновлення (відповідно 2 і 5)
Mn+7 +5ē → Mn+2 2
S-2 -2ē → S0 5
- підставляють ці коефіцієнти в рівняння реакції й знаходять коефіцієнти для інших речовин звичайним шляхом. Дане рівняння буде мати такий вид:
2KMnO4 + 8H2SO4 + 5Na2S → 5S + 2MnSO4 + K2SO4 + 5Na2SO4 + 8H2O.
4.2 Практична частина
Дослід 1.
Узяти дві пробірки. В одну помістити 3-4 краплі розчину KMnO4, підкислити розведеним розчином сірчаної кислоти й додати розчин NaNO2 до його знебарвлення.
NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + ….
В іншу пробірку внести 3-4 краплі розчину KI, підкислити розведеним розчином сірчаної кислоти й додати розчин NaNO2 до зміни коліру.
KI + NaNO2 + H2SO4 → I2 + NO + ….
Як пояснити спостережувані явища?
Дописати рівняння реакції. У якому випадку нітрит – іони проявляють відновлювальні й у якому – окиснюванні властивості?
Дослід 2.
До 3-4 крапель хлорного заліза додати 6-8 крапель йодиду калію. Виділяється вільний йод. Як змінюється колір у розчині?
FeCl3 + KI → FeCl2 + KCl + I2
Як міняється ступінь окиснення елементів у сполуках? Що окиснювач і відновлювач?
Дослід 3.
Налити в пробірку 2-5 крапель розчину біхромату калію (K2Cr2O7), додати 1-2 краплі розчину сірчаної кислоти. В отриманий розчин всипати лопаточкою щіпку сульфіту натрію Na2SO3.
Спостерігати як змінюється колір у розчині.
K2Cr2O7 + H2SO4 + Na2SO3 → Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O
Укажіть окиснювач і відновлювач.
а) Скільки елементів міняють свій ступінь окиснення в сполуках?
б) Які функції кислоти в реакції?
Дослід 4.
а) Додати в пробірку 2-3 краплі перманганату калію (колір?), додати 1-2 краплі розчину луги. Потім шпателем додати в пробірку небагато кристаликів Na2SO3.
Як зміниться колір у розчині?
б) Додати в пробірку 2-3 краплі розчину KMnO4, додати 2-3 краплі розчину сірчаної кислоти й 3-4 краплі розчину йодиду калію.
Як зміниться колір розчину?
Підберіть коефіцієнти в рівняннях:
KMnO4 + NaOH + Na2SO3 → Na2SO4 + Na2MnO4 + K2MnO4 + H2O
KMnO4 + H2SO4 + KI → I2 + K2SO4 + H2O ….
Дослід 5.
Обережно нагріти під витяжною шафою в сухій пробірці невелику щіпку перманганату калію до утворення пофарбованого в зелений колір манганату
t
KMnO4 → K2MnO4 + MnO2 + ….
Отриману сіль розчинити у воді.
Звернути увагу на перехід зеленого фарбування у фіолетове – червоне й появу осаду.
K2MnO4 + H2O → KMnO4 + MnO2 + ….
Дописати рівняння реакції, розставити коефіцієнти й указати, до якого типу відносяться ці окисно – відновні реакції.
4.3 Контрольні питання та завдання
1. Визначите ступінь окиснення хрому й сірки в сполуках: K2Cr2O7, KСrО2, H2SO4, Na2S2O3, K2S.
2. Укажіть ступінь окиснення й ковалентність азоту та йоду в молекулах: N2 і I2.
3. Які реакції називаються ОВР? Які з наведених нижче реакцій є окисно – відновними? Укажіть у них окиснювач і відновлювач:
AlCl3 + 4KOH → K[Al(OH)4] + 3KCl;
S + KOH → K2S + K2SO3 + H2O;
Mg + HNO3 → Mg(NO3)2 + N2O + H2O;
K3PO4 + HCl → KCl + H3PO4.
4. Які з наступних реакцій:
Na2S + HCl → NaCl + H2S;
HBr + H2SO4 → Br2 + SO2 + H2O;
FeSO4 + H2SO4 + KClO3 → Fe2(SO4)3 + KCl + H2O.
є ОВР? Складіть для них електронні рівняння й укажіть для кожної реакції, яка речовина окислиться, а яка – відновиться.
5. Які з наступних реакцій:
H3PO3 + HNO3 → H3PO4 + NO + H2O;
FeCl3 + SnCl2 → FeCl2 + SnCl4;
AgNO3 + NaCl → AgCl + NaNO3.
є ОВР? Складіть для них електронні рівняння й укажіть для кожної реакції, яка речовина окислиться, а яка – відновиться.
6. Реакції протікають за схемою:
Zn + HNO3 → Zn(NO3)2 + H2O;
SO2 + K2Cr2O7 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
Розставте коефіцієнти й укажіть для кожної реакції, яка речовина є окиснювачем, яка – відновлювачем.
7. Реакції протікають за схемою:
KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O;
MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O.
Розставте коефіцієнти й укажіть для кожної реакції, яка речовина є окиснювачем, а яка – відновлювачем.
Лабораторна робота № 5
Кінетика хімічних реакцій
5.1 Швидкість хімічних реакцій
5.1.1 Теоретична частина
Швидкість реакції визначається зміною концентрації одної з реагуючих речовин в одиницю часу. Концентрацію звичайно виражають числом молів в одному літрі розчину, час – у секундах. Дійсна швидкість реакції в цей момент часу визначається як перша похідна від концентрації за часом τ. Нехай C – концентрація вихідної речовини, тоді відповідно до того, що dτ > 0, dC < 0 маємо:
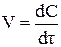 .
.
Швидкість реакції залежить від природи реагуючих речовин і умов протікання реакції, концентрації реагентів, температури й присутності каталізаторів (для реакцій за участю твердих речовин також від ступеня їх здрібнювання). Для газів швидкість реакції залежить і від тиску, тому що в цьому випадку зі зміною тиску змінюється концентрація реагентів.
Залежність швидкості реакції від концентрації для елементарних процесів виражається законом дії мас: швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин.
При взаємодії двох речовин А и В швидкість реакції виражається рівнянням:
V = k · [A] · [B],
де [A] і [B] молярні концентрації речовин;
k – константа швидкості, що залежить від природи взаємодіючих речовин, каталізаторів і температури.
Для реакцій, у яких бере участь кілька молекул, концентрації беруться з відповідним показником ступеня. Так, наприклад, у процесі
2A + B → A2B
за умови, що реакція не проходить у дві або кілька стадій,
V = k · [A]2 · [B].
Якщо в реакції, крім газу й рідини, бере участь також тверда речовина, концентрація якого (число молей в одиниці об'єму) постійна, то швидкість реакції змінюється тільки залежно від концентрації газів або розчинених речовин. Наприклад, у системі газ – тверде тіло, зіткнення між молекулами газу й твердої речовини можуть відбуватися лише на поверхні роздягнула фаз, таким чином, маса твердої фази не впливає на швидкість реакції. Так, швидкість реакції
CuО + H2 → Cu + H2O, V = k ∙ [H2]
пропорційна тільки концентрації водню. При підвищенні температури на кожні 100С швидкість реакції зростає в 2-4 рази. Якщо відома швидкість реакції при t1 (Vt1) і якщо прийняти, що при підвищенні температури на 100С вона зростає в 2 рази, то швидкість реакції при будь-якій температурі приблизно може бути обчислена по формулі 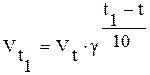 .
.
5.1.2 Практична частина
Дослід 1. Залежність швидкості реакції від концентрації реагуючих речовин
У три пробірки налити по 5 мл розчину H2SO4, а в три інші – у першу 15 мл розчину Na2S2O3, у другу 10 мл розчину Na2S2O3 + 5 мл Н2О и в третю 5 мл розчину Na2S2O3 + 10 мл Н2О. Об'єми точно відміряти мірною бюреткою.
Взаємодія розчину тіосульфату натрію із сірчаною кислотою протікає по рівнянню
Na2S2O3 + H2SO4 → H2S2O3 + Na2SO4,
H2S2O3 → H2SO3 + S.
Зливати по черзі попарно приготовлені розчини H2SO4 і Na2S2O3 (перший розчин доливають до другого) і відраховувати час до появи каламуті по секундоміру з моменту зливання в кожній пробірці. Результати зводять у таблицю 5.1.
Таблиця 5.1 – Результати визначення залежності швидкості реакції від концентрації реагуючих речовин
| Номер досліду | Об'єм, мл | Концентрація
Na2S2O3,
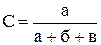
| Проміжок часу від початку відліку до появи каламуті, τ, с | Швидкість реакції,
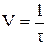
| ||
| Na2S2O3 а | Н2О б | H2SO4 в | ||||
| - | ||||||
На міліметровому папері побудувати графік залежності V (вісь ординат) від C (вісь абсцис). Рекомендується брати міліметровий папір розміром приблизно 10 х 10 см. Масштаб слід вибирати таким чином, щоб найбільші значення величин по осі ординат і по осі абсцис перебували на відстані не менш 8 см від початку координат. Відповідно до закону діючих мас, залежності реакції від концентрації повинна виражатися прямою лінією, що проходить через початок координат.
Як впливає зміна концентрації реагуючих речовин на швидкість реакції?
Дослід 2. Вплив температури на швидкості реакції
У три пробірки налити по 10 мл розчину Na2S2O3, а в три по 10 мл розчину H2SO4. Помістити всі пробірки в склянку з водою й через 5-7 хвилин, вимірявши температуру в склянці, злити разом уміст однієї пари пробірок з H2SO4 і Na2S2O3 і відраховувати час по секундоміру з моменту зливання й початку появи каламуті.
У склянку із пробірками, що залишилися, додати гарячої води стільки, щоб температура була на 100С більше, ніж початкова, і знову витримувати 5 хвилин. Злив уміст другої пари пробірок з H2SO4 і Na2S2O3, визначити час до початку появи каламуті.
Дослід з останньою парою пробірок проводити при температурі на 200С вище первісній. Результати зводити в таблицю 5.2.
Таблиця 5.2 – Результати визначення впливу температури на швидкість реакції
| Номер досліду | Об'єм, мл | Температура досвіду, t, oc | Проміжок часу від початку відліку до появи каламуті, τ, с | Швидкість реакції,
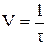
| |
| Na2S2O3 | H2SO4 | ||||
Побудувати графік залежності швидкості реакції від температури, відклавши на осі абсцис у певному масштабі температури дослідів, а на осі ординат – величини швидкості реакції.
Як змінюється швидкість даної реакції при підвищенні температури на кожні 100С?
5.1.3 Контрольні питання й завдання
1. Чим виміряється швидкість реакції, від яких факторів вона залежить?
2. Які реакції називаються гомогенними й гетерогенними? Наведіть приклади.
3. Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас і його математичне вираження.
4. Залежність швидкості реакції від температури. Температурний коефіцієнт реакції. Які значення він може мати? Правило Вант – Гоффа.
5.2 Хімічна рівновага
5.1.1 Теоретична частина
Усі хімічні реакції можна розділити на оборотні й необоротні. Перші протікають одночасно в прямому й зворотному напрямках, але з різною швидкістю: через якийсь час після їхнього початку швидкості прямої і зворотної реакції стають однаковими та наступає хімічна рівновага. До необоротних реакцій належать реакції які протікають в одному напрямку до повного зникнення вихідних речовин. До них відносяться процеси, що супроводжувалися випаданням осаду, виділенням газу, утворенням, у випадку іонних реакцій, малодисоціованих речовин і т.п., а також процеси, що супроводжуються виділенням теплоти.
Для будь-якої оборотної реакції aA + вB ↔ rR + sS
у стані рівноваги виконується співвідношення
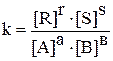 .
.
де [А], [В] – концентрації речовин у момент рівноваги;
k – константа хімічної рівноваги, яка залежить від температури.
Наприклад, для реакції N2 + 3H2 ↔ 2NH3
Це рівняння буде мати вигляд: 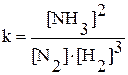 .
.
Якщо при рівновазі, що встановилася, побільшати концентрацію азоту або водню, то повинна відповідно зрости концентрація аміаку.
Отже, для зсуву рівноваги ліворуч або праворуч необхідно або побільшати концентрацію одного з вихідних речовин, або зменшити концентрацію одного із продуктів реакції. Для зсуву рівноваги у зворотному напрямку потрібно підвищити концентрацію одного із продуктів реакції.
Напрямок зсуву рівноваги залежно від зміни концентрації, температури або тиски в загальному виді визначається принципом Лє – Шател’є: якщо на систему, що перебуває в рівновазі, оказується ззовні будь якій вплив, то в ній виникають процеси, які зменшують ефект цього впливу.
Так, при підвищенні температури рівновага зміщається убік реакції, що йде з поглинанням тепла. При підвищенні тиску рівновага зміщається убік тієї реакції, яка супроводжується зменшенням об'єму системи; якщо реакція йде без зміни об'єму, то зміна тиску не змінює хімічну рівновагу.
Наприклад, у реакції синтезу аміаку із чотирьох об'ємів вихідних газів виходить два об'єми, тому збільшення тиску буде зміщати рівновагу вправо. Підвищення температури змістить рівновагу вліво, убік ендотермічної реакції розкладання, і вихід аміаку в стані рівноваги поменшиться.
5.2.2 Практична частина
Дослід 1. Вплив концентрації реагуючих речовин на хімічну рівновагу
Для досліду зручно скористатися наступною реакцією:
FeСl3 + 3KCNS ↔ Fe(CNS)3 + 3KСl
З речовин цієї системи Fe(CNS)3 інтенсивно пофарбований у червоний колір, у той час як розведений розчини FeСl3 слабко пофарбовані в жовтий колір, а KCNS і KСl безбарвні. Тому всяка зміна концентрації Fe(CNS)3 позначається на зміні фарбування розчину. Це дозволяє спостерігати, у якому напрямку зрушується рівновага при зміні концентрації реагуючих речовин.
У пробірку налити по 4 краплі розчину FeСl3 і KCNS (або NH4CNS). До отриманого розчину додати таку кількість дистильованої води, щоб його стало більш половини пробірки. Розчин розділити навпіл на чотири пробірки: у першу додасть 4 краплі розчину FeСl3, у другу – 2 краплі KCNS або NH4CNS і в третю – кілька кристаликів KСl або NH4Cl. Четверту пробірку залишити для порівняння. Зіставити інтенсивність фарбувань отриманих розчинів з кольором розчину в четвертій пробірці й, користуючись вираженням константи хімічної рівноваги
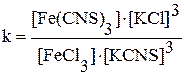 ,
,
пояснити зміни фарбування розчинів у першій, другій і третій пробірках. Результати досвіду зводяться в таблицю 5.3.
Таблиця 5.3 – Вплив концентрації реагуючих речовин на хімічну рівновагу
| Номер пробірки | Доданий розчин | Зміна інтенсивності фарбування (посилення, слабшання) | Напрямок зсуву рівноваги (уліво, вправо) |
Як можна оборотну реакцію довести практично до кінця?
5.2.3 Контрольні питання й завдання
1. Які реакції називаються оборотними й необоротними? Приведіть приклади гомогенних і гетерогенних оборотних реакцій.
2. Що називається константою рівноваги хімічної реакції? Від яких факторів вона залежить?
3. Яким чином можливо змістити хімічну рівновагу? Сформулюйте принцип Лє-Шател’є. Яким чином і які умови треба змінити, щоб наступні рівноваги змістити вліво (вправо?)
3H2 + N2 ↔ 2NH3 - ∆H;
H2 + I2 ↔ 2HI - ∆H;
3SO2 ↔ 2SO3 + ∆H;
3NH4CNS + FeСl3 ↔ Fe(CNS)3 + 3 NH4Cl.
Лабораторна робота № 6
Хімічні властивості металів
6.1 Теоретична частина
Електрохімічний ряд напруги дає кількісну характеристику активності всіх металів у водяних розчинах.
Усі метали легко віддають електрони й тому є гарними відновлювачами. Відновлювальні властивості убувають від калію до платини.
Іони металів можуть приймати електрони й проявляти окиснювальні властивості. У напрямку від іона калію до іона платини окиснювальні властивості підсилюються.
Зі сказаного випливає, що кожний метал витісняє з розчинів солей усі інші метали, які розташовані після нього в ряді напруги, наприклад:
CuSO4 + Fe → Cu + FeSO4.
Багато металів, що розташовані до водню, можуть витісняти водень із води.
При взаємодії води з металом утворюється гідроксид металу й водень. При звичайних умовах легше всього з водою взаємодіють найбільш активні метали (лужні та лужноземельні), наприклад:
2Na + 2H2O → 2NaОН + H2↑.
З розведеними розчинами HСl і H2SO4 взаємодіють тільки метали, що розташовані у ряді напруги до водню. У цих випадках іони водню є окиснювачами, а атоми металів – відновлювачами. Тому буде виділятися вільний водень, наприклад:
Zn + H2SO4 → ZnSO4 + H2↑.
Концентрована соляна кислота на метали діє подібно розведеної.
У концентрованій сірчаній кислоті розчиняються багато металів, крім золота, платини й деяких інших. Тому що ступінь дисоціації концентрованої сірчаної кислоти мала (приблизно 1%), іонів водню в ній дуже мало, тому в ролі окиснювача виступають іони S+6.
При взаємодії металу, що розташований в ряді напруги після водню, іон S+6 звичайно відновлюється до S+4 і виділяється SО2, наприклад:
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2.
При взаємодії металу, що розташований в ряді напруги після водню, іони S+6 можуть також відновлюватися до S0 або S- 2, внаслідок чого виділяється вільна сірка або сірководень, наприклад:
4Mg + 5H2SO4 → 4MgSO4 + 4H2O + H2S.
Інакше взаємодіє з металами азотна кислота. В азотній кислоті розчиняються багато металів, крім деяких – золота, платини й ін.
При взаємодії концентрованої азотної кислоти з металами звичайно утворюється сіль, діоксид азоту й вода, наприклад:
Cu + HNO3 → Cu(NO3)2 + 2NO2 + H2O.
Багато металів легко розчиняються в розведеній азотній кислоті, утворюючи сіль, воду й оксид азоту. Замість оксиду азоту може виділятися також N2 або NH4NO3. Це пов'язане з тим, що чім розведеній азотна кислота, активніше відновлювач і вище температура, тим повніше відновлюється азот (+5) за схемою:
+5 +4 +2 0 -3
HNO3 → NO2 → NO → N2 → NH3
При розчиненні металів в азотній кислоті водень ніколи не виділяється, наприклад:
3Zn + 8HNO3 → Zn(NO3)2 + 2N2 + 4H2O.
У концентрованих холодних H2SO4 і HNO3 деякі метали (Cr, Al, Fe) пасивуються.
З розчином лугу реагують тільки ті метали, гідроксиди яких амфотерні (наприклад, Zn, Al і ін.)
Дія розчинів лугу йде по стадіях. Спочатку метал взаємодіє з водою:
Zn + 2H2O → Zn(OH)2 + H2↑,
а потім гідроксид розчиняється в лузі:
Zn(OH)2 + 2NaОН → Na2ZnО2 + H2O.
6.2 Практична частина
Дослід 1. Дія води
В одну пробірку помістити кілька шматочків магнію, а в другу міді, потім в обидві пробірці долити небагато води й додати 2-3 краплі фенолфталеїну.
Що спостерігається? Написати рівняння реакцій.
Дослід 2. Дія розведеної сірчаної кислоти
В одну пробірку помістити кілька шматочків цинку, а в другу міді, потім в обидві пробірці долити декілька крапель сірчаної кислоти й підігріти.
Що спостерігається? Написати рівняння реакцій.
Дослід 3. Дія розведеної соляної кислоти
У пробірку помістити шматочок алюмінію й долити трохи крапель розведеної соляної кислоти.
Написати рівняння реакції.
Дослід 4. Дія концентрованої соляної кислоти
(У витяжній шафі з включеною тягою!) Шматочок олова помістити в пробірку й долити декілька крапель концентрованої соляної кислоти. Спостерігати виділення водню й утворення SnСl2. Отриманий розчин разом з оловом вилити в спеціальну посудину, яка розташована у витяжній шафі. Написати рівняння реакції.
Дослід 5. Дія концентрованої сірчаної кислоти
а) У пробірку (У витяжній шафі з включеною тягою!) помістити шматочок міді й долити декілька крапель концентрованої сірчаної кислоти. Нагріти. Спостерігати виділення газу й утворення блакитного розчину міді.
Написати рівняння реакції.
б) У пробірку помістити шматочок цинку, долити трохи крапель концентрованої сірчаної кислоти. Підігріти. Спостерігати жовтий наліт сірки на стінках пробірки й виділення газу. Перевірити, чи не виділяється сірководень, для цього узяти смужку фільтрувального паперу, змочити розчином солі свинцю й опустити в пробірку. Нагріти. Якщо папірець почорніє від чорного сульфіду, що утворився на ньому, це доводить, що утворився сірководень. Написати рівняння реакцій.
Дослід 6. Дія азотної кислоти. (Працювати тільки у витяжній шафі)
а) Концентрована азотна кислота
У пробірку помістити шматочок міді, долити трохи крапель концентрованої азотної кислоти й нагріти. Спостерігати виділення бурого газу й появу блакитного розчину солі міді. Написати рівняння реакції.
б) Розведена азотна кислота
У пробірку помістити шматочок цинку, долити трохи крапель розведеної азотної кислоти, спостерігати виділення безбарвного газу оксиду азоту й появу блакитного розчину солі міді. Написати рівняння реакції.
Дослід 7. Дія розчину луги
У пробірку помістити шматочок алюмінію. Налити трохи крапель концентрованого розчину луги. Небагато нагріти. Спостерігати виділення водню й утворення розчину алюмінату. Написати рівняння всіх стадій.
Дослід 8. Дія розчинів солей
У кожну із трьох пробірок налити по трохи капель розчинів солей міді, магнію, свинцю. Додати по шматочку цинку. Відзначити, де відбулися зміни. Написати рівняння реакцій.
6.3 Контрольні питання й завдання
1. Чому розчини лугів не можна зберігати в цинковій або алюмінієвій тарі? Відповіді підтвердити рівняннями реакцій.
2. Які метали можуть розкладати воду? Указати їхнє положення в електрохімічному ряді напруги.
3. Які із зазначених металів (магній, срібло, цинк, мідь, алюміній) взаємодіють із соляною кислотою. Скласти рівняння реакцій.
4. Срібло не взаємодіє з розведеною сірчаною кислотою, тоді як у концентрованій воно розчиняється. Чим це можна пояснити? Складіть рівняння відповідної реакції.
5. Складіть рівняння реакцій взаємодії цинку: а) з розчинами їдкого натру, б) концентрованої сарною кислотою, враховуючи відновлення сірки до нульового ступеня окиснення.
6. Відомо, що 0,43г металу при реакції з водою витісняє 123,2 см3 газу, обмірюваного при нормальних умовах, і що 1,56г цього металу вступає у взаємодію з 1,415г хлору. Який це метал?
7. Які метали взаємодіють із водяним розчином лугу (складіть рівняння реакцій)?
8. Указати метали, які пасивуються в концентрованої сірчаною й азотної кислотах.
9. Складіть рівняння реакцій взаємодії магнію, цинку, кадмію й міді з концентрованою сірчаною кислотою.
10.Складіть рівняння реакцій взаємодії алюмінію й цинку з лугом.
Лабораторна робота № 7
Гальванічні елементи. Корозія металів
7.1 Гальванічні елементи
7.1.1 Теоретична частина
Гальванічні елементи –це хімічне джерело електричної енергії, яка утворюється за рахунок окисно – відновлювального процесу. При цьому реакція окиснення відбувається на одному електроді (аноді), а реакція відновлення – на іншому електроді (катоді). Роль анода відіграє метал з більш низьким значенням електродного потенціалу (ЕА < ЕК).
Так, у мідно – цинковому гальванічному електроді
(-) Zn0 | Zn2+ || Cu2+ | Cu0 (+)
Zn – від’ємний електрод, анод, джерело електронів;
Cu – додатній електрод, катод.
В елементі протікає реакція
(анод) Zn0 - 2ē → Zn2+ (окиснення)
(катод) Cu2+ + 2ē → Cu0 (відновлення)
ЕДС (∆Е) дорівнює різниці електродних потенціалів ∆Е = ЕК - ЕА.
Безпосередній вимір Е.Д.С. гальванічного елемента за допомогою звичайного вольтметра не здійсненне, оскільки останній показник не Е.Д.С., а спадання напруги, що залежить від опір вольтметра.
7.1.2 Практична частина
Дослід 1. Виникнення гальванічної пари
У дві пробірки помістити по шматочку цинку, після чого в кожну з них долити трохи крапель розведеного розчину сірчаної кислоти. Відзначити слабке виділення водню. Потім в одну із пробірок долити 1-2 краплі розчину сульфату міді, а в іншу опустити мідний дротик до зіткнення із цинком.
Спостерігати більш інтенсивне виділення водню за рахунок утворення гальванічної пари Cu | H2SO4 | Zn. Пояснити роботу даної гальванічної пари. Відзначити анод і катод.
Дослід 2.Принцип дії гальванічного елемента.
У склянку з розведеним розчином сірчаною або соляної кислоти занурити приблизно на 3/4 мідну й цинкову пластинки. До зовнішніх кінців пластинок приєднати чутливий гальванометр. Спостерігати відхилення стрілки гальванометра. Скласти схему елемента й написати рівняння реакцій, що протікають у катода й анода.
7.1.3 Контрольні питання й завдання
1. Як улаштований гальванічний елемент і як виміряти Е.Д.С. гальванічного елемента?
2. Складіть електронні рівняння процесів, що протікають при корозії залізної пластинки, склепленої з мідною й зануреною у розчин сірчаної кислоти.
3. Обчислити Е.Д.С. мідно – цинкового елемента, у якому концентрація іонів міді в розчині CuSO4 рівна 0,0005 моль/л, а іонів цинку в розчині ZnSO4 – 0
| <== попередня сторінка | | | наступна сторінка ==> |
| Закон сохранения энергии. | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |