
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Проведення дослідів
Дослід 1. Приготування твердої води
У колбу наливають 20-30 мл вапняної води, стільки ж - дистильованої і додають 5-6 мл насиченого розчину сульфату кальцію. За допомогою апарату Кіппа в розчин пропускають вуглекислий газ. Осад, що утворився при подальшому пропусканні вуглекислого газу, повністю розчиняється. Записати рівняння реакцій.
Одержану тверду воду залишають для наступних дослідів.
Дослід 2. Видалення солей твердості
Наливають у чотири пробірки по 4-5 мл води, одержаної в першому досліді. Воду в одній пробірці нагрівають до кипіння. Чому виникло помутніння? Яка твердість усувається кип’ятінням? Складають рівняння реакції. В решту пробірок додають: в першу - розчин соди, в другу - вапняну воду і в третю - розчин фосфату натрію. Що відбувається в пробірках? Скласти рівняння реакцій в молекулярному та іонному виді.
Дослід 3. Визначення тимчасової (карбонатної) твердості води
В основі методу лежить реакція між соляною кислотою і гідрокарбонатами: Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2
Тимчасова твердість дорівнює кількості соляної кислоти в одиницях мілімолярної концентрації еквівалента (мг-екв), що витрачена на титрування 1 л води.
Наливають в дві колби по 100 мл досліджуваної води і додають по 2-3 краплі метилоранжу. Воду в одній колбі залишають для контролю, а в другу колбу з бюретки краплинами додають розчин соляної кислоти з молярною концентрацією 0,1 моль/л, до тих пір поки від однієї краплини кислоти забарвлення з жовтого не перейде в жовтогаряче (порівняйте із забарвленням води в контрольній колбі). Титрування проводять 2-3 рази; для розрахунків необхідно взяти середній результат. Оскільки реакції протікають між еквівалентними кількостями речовин, то відповідно до закону еквівалентів у взятому об’ємі води міститься така кількість гідрокарбонатів кальцію й магнію в одиницях мілімолярної концентрації еквівалента (мг-екв), скільки HClміститься в об’ємі соляної кислоти, що був витрачений на титрування. Формула для визначення твердості води, мг-екв/л:
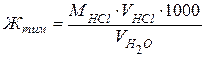 ,
,
де Жтим - карбонатна (тимчасова) твердість води;
МHCl - молярна концентрація розчину соляної кислоти;
VHCl – об’єм розчину HCl, використаний на титрування води (середнє значення з трьох вимірів);
VH2O – об’єм води, взятої для титрування.
Дослід 4. Якісне визначення іонів Ca2+ у воді
Беруть три однакові пробірки, в одну наливають 5 мл води, отриманої в досліді 1, в другу - 5 мл води з водогону, у третю – 5 мл дистильованої води. У кожну пробірку додають по 1 мг розчину NH4OH і по 2-3 мл розчину оксалату амонію (NH4)2C2O4. Порівнюють вміст пробірок. Де утворився осад? Записують рівняння реакцій.
Дослід 5. Якісне визначення іонів SO42- у воді
В одну пробірку наливають 5 мл води, отриманої в досліді 1, в другу - 5 мл з водогону і в третю - 5 мл дистильованої води. В кожну пробірку додають по 2-3 мл розчину хлориду барію. Де утворився осад? Записують рівняння реакцій.
Дослід 6. Дія мила на м’яку та тверду воду
Наливають в одну пробірку 5-6 мл води з водогону, а в другу - такий же об’єм дистильованої води. Додають в кожну пробірку піпеткою по 0,5 мл мильного розчину, збовтують вміст пробірок до зникнення піни. Після цього додають знову по 0,5 мл мильного розчину і знову збовтують. Так повторюють доти, доки не утвориться стійка піна. Яка кількість мильного розчину пішла на утворення стійкої піни в кожній пробірці? Чому?
Лабораторна робота №11
| <== попередня сторінка | | | наступна сторінка ==> |
| ТВЕРДІСТЬ ВОДИ | | | АЛЮМІНІЙ І ЙОГО СПОЛУКИ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |